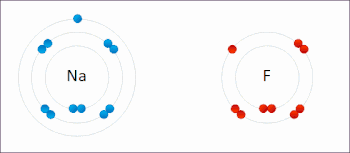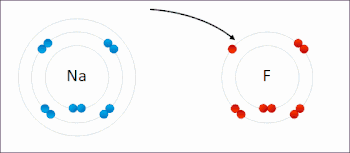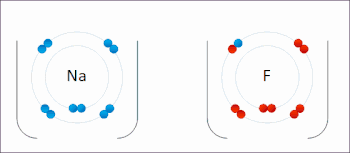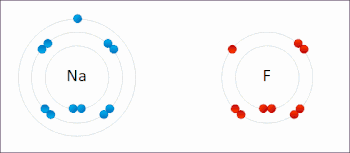
In redoksreaksje is in reaksje tusken atomen, molekulen en ioanen, dêr't elektroanen útwiksele wurde. De term redoks is in gearstalling fan de begripen reduksje en oksidaasje: REDuksje en OKSidaasje. Dy soarte reaksje wurdt in soad brûkt yn batterijen en akkú's. Ek rustkjen is in redoksreaksje, en wol de oksidaasje fan izer.
Reaksje
By in redoksreaksje binne in reduktor (elektroane-ôfstjitter) en in oksidator (elektroane-oannimmer) belutsen. Dat kinne fan alle dieltsjes wêze, sawol ioanen as molekulen. Der kinne twa heale reaksjes opsteld wurde, en wol it ôfstean fan elektroanen troch de reduktor (oksidaasje) en it opnimmen fan elektroanen troch de oksidator (reduksje). As de reduktor en oksidator ferbûn wurde, en der in elektrolyt ta beskikking foar it ioaneferfier komt, kin de reaksje plakfine. De oksidator en reduktor hoege net streekrjocht yn kontakt meiïnoar te stean.
In reduktor kin mei alle oksidators reagearje dy't sterker binne as syn konjugearre oksidator. Oarsom kin in oksidator mei alle reduktors reagearje dy't sterker binne as syn konjugearre reduktor.
In redoksreaksje wurdt as ôfrinnend beskôge, as de elektroadepotinsjaal fan de oksidator 0,3 folt of mear, heger is as dy fan de reduktor. As it ferskil tusken de 0,3 en -0,3 folt is, stelt der in lykwicht yn en as de elektroadepotinsjaal fan de oksidator 0,3 folt of mear, leger is as dy fan de reduktor, wurdt der praat fan dat de reaksje net ferrint.
Binne de konsintraasjes fan de homogeen ferparte reaksjestoffen allegear lyk oan 1 mol L−1 (en boppedat T=298K en p=p0), dan is de elektroadepotinsjaal lyk oan de standertpotinsjaal.
De elektroadepotinsjaal is in mjitte foar de termodynamyske driuwende krêft fan in heale reaksje en seit neat oer de gong (kinetyk) fan de heale reaksje. Sa kin de oksidatorpotinsjaal mear as 0,3 folt heger wêze as de reduktorpotinsjaal en de reaksje dochs amper ferrinne kin.
In redoksreaksje wurdt yn it algemien sa werjûn:
- Reduktor → reaksjeprodukt + e− (oksidaasje)
- Oksidator + e− → reaksjeprodukt (reduksje)