
It ammoanium-ion is in kation, dat mei anioanen, lykas as mei alkalimetaal-ioanen, sâlten foarmet. It hat de skiekundige formule NH4+. It is in konjugearre soer taheake oan de tsjinsoer ammoniak (NH3). Ammoaniumsâlten binne bygelyks ammoaniumnitraat (NH4NO3) en ammoaniumgloride (NH4Cl).
It ammoanium-ion is in swak soer. Yn in tsjinsoer miljeu sil it him as soer foardwaan en in H+-ion ôfstean. Yn in neutraal of soer miljeu sil it wetterstof-ion oan it ammoanium-ion bûn bliuwe. Yn de organyske gemy komme ammonium-ioanen foar. Yn dy ioanen binne ien of mear fan de wetterstof-ioanen ferfongen troch koalstofgroepen.
Eigenskippen
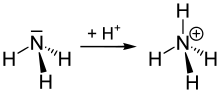
De gemyske ferbining is likernôch:
It frij elektroanepear fan de stikstof (N) yn ammoniak is oanjûn as it pear stippen. Dat elektroanepear foarmet in bining mei in wetterstof-ion (H+).
Yn syn reaksjes liket it ammoanium-ion tige op natrium- en kalium-ioanen. Kreksa as dy ioanen komt ammoanium foar as kation NH4+. In soad alkalimetaalsâlten hawwe in fariant, dêr't it ammoanium-ion it plak ynnimt fan in alkalimetaal-ion. Kreksa as dy sâlten binne ek de ammoaniumsâlten reedlik goed op te lossen.
Oars as by de alkalimetalen kin ammonium net troch reduksje út in sâlt frijmakke wurde:
- Na+ + e− → Na (metaal)
- 2NH4+ + 2e− (→ 2NH4) → 2NH3 + 2H
- 2H → H2
Troch de reduksje ûntstiet daliks in opdieling, dêr't ammoniak en wetterstof foarme wurde.
In oar ferskil mei de alkalimetaalsâlten is dat as it negative ion oksidearjende skaaimerken hat, it sâlt troch hjitsjen maklik opdielt; it negatyf ion oksidearret dan it ammoanium-ion en it ammoanium-ion redusearret it negative ion, sa as bygelyks by ammoaniumnitraat. By it hjitsjen ûntstiet gniisgas en wetterdamp.
- NH4NO3 → N2O + 2 H2O
Ammoanium yn de natuer
Yn de natuer ûntstiet ammoanium benammen by it ôfbrekken fan aaiwiten. Sa wurdt it troch fisken en measte oare wetterorganismen as einprodukt troch bygelyks de kiuwen útskaat. Ek fan it ferrotsjen fan dea organysk materiaal wurdt it as einprodukt frijlitten. It spilet in wichtige rôl yn de sitroensoerrûntegong, dêr't it mei alfa-ketoglutaraatsoer ta glutaminesoer reagearret.
Ammoanium wurdt yn de grûn en yn gewaaksen mei soerstof troch baktearjes, sa as fan de skaaien fan de nitrosomonas, ynearsten ta nitryt en dan troch in oare skaai, de nitrobakter, fierder ta nitraat oksidearre. Njonken baktearjes spylje by it oksidearjen fan ammonium yn de grûn ek archaea in wichtige rôl. Dat proses wurdt nitrifikaasje neamd en is wichtich foar it boaiemlibben. Ek foar gewaaksen is de nitrifikaasje in wichtich part fan it skjinmeitsjen fan harsels.
Ammoniak is foar fisken al yn in lytse hoemannichte fergiftich. In ammoaniumgehalte yn it wetter fan 0,5 oant 1 mg/l is it heechste dat fisken tasean kinne. By ammoaniumgehalten fan 1mg/l of heger yn it wetter is net gaadlik foar fiskerijdoelen.
Gebrûk
Ammoaniumsâlten wurde brûkt yn it meitsjen fan keunstdong. It ammoaniumsâlt fan it tioglikolsoer wurdt as reduksjemiddel brûkt foar in permaninte hierweach
| Boarnen, noaten en/as referinsjes: |
|
Foar boarnen en oare literatuer, sjoch ûnder: Einzelnachweise, op dizze side. |