Ubikitiini
Ubikitiini (latinasta ubique, "kaikkialla") on pieni säätelyproteiini, jota löytyy lähes kaikista kudoksista eukaryooteista[1]. Ubikitiinin lisääminen proteiiniin ohjaa sen proteasomiin hajotettavaksi[2]. Aaron Ciechanover, Avram Hershko ja Irwin Rose saivat Nobelin kemianpalkinnon vuonna 2004 ubikitiinin löytämisestä[3]. Ubikitiini tunnistettiin ensimmäisen kerran jo vuonna 1975.[1]

Ihmisen ubikitiiniproteiinin sekundäärirakenne. Lysiini-sivuketjut oranssilla.
Ubikitinaatio
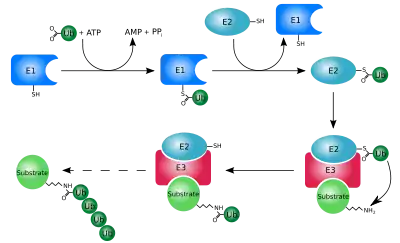
Ubikitiinin liittämiseen eli ubikitinaatioon osallistuu kolme entsyymiä, E1, E2 ja E3. Ubikitiinejä voidaan liittää useita peräkkäin samaan proteiiniin. Entsyymi E1 aktivoi ubikitiinin niin, että E2 pystyy siirtämään sen E3-ubikitiiniligaasille, joka kykenee liittämään ubikitiinin kohdeproteiiniin.[2]
Lähteet
- The Nobel Prize in Chemistry 2004 - Popular information Nobelprize.org. Viitattu 16.5.2012. (englanniksi)
- Jyrki Heino, Matti Vuento: Solubiologia, s. 173. 2. uudistettu painos. WSOY, 2004. ISBN 951-0-28955-8. (suomeksi)
- The Nobel Prize in Chemistry 2004 Nobelprize.org. Viitattu 16.5.2012. (englanniksi)
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.