Tyrosiinikinaasireseptorit
Tyrosiinikinaasireseptorit eli RTK:t ovat ryhmä solukalvoihin upottautuneita reseptoreita, jotka toimivat tyrosiinikinaasientsyymeinä. RTK:t luetaan siksi entsyymireseptoreihin. RTK:t ovat toiminnollisia ollessaan kiinnittyneenä johonkin toiseen sopivaan RTK:hon kahden reseptorin pariksi, eli dimeeriksi. RTK:n sitoessa sille ominaisen ligandin, sen kinaasiaktiivisuus kasvaa ja dimeerin RTK:t liittävät toistensa tyrosiineihin fosfaattiryhmiä. Näihin tyrosiineihin kiinnittyy sitten tiettyjä proteiineja, jotka välittävät reseptorisignaalin eteenpäin solussa.[1] Insuliinireseptori on esimerkki RTK:sta. Eräs sen sisäsyntyisistä ligandeista on insuliini.[2] Tiettyjen RTK:iden toiminta on kiihtynyt useissa syövissä, jonka takia on kehitetty näitä RTK:ita estäviä syöpälääkkeitä, jollaisesta esimerkki on imatinibi.[1] RTK:ita kutsutaan myös nimellä reseptorin proteiini-tyrosiinikinaasit.[3]
Rakenne
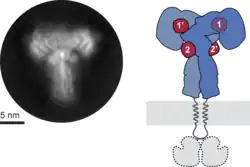
RTK:t läpäisevät solukalvon tai jonkin muun kaksoislipidikalvon yhdellä noin 20 aminohapon pituisella α-kierteellä, jolla ne pysyvät kiinni kalvossa. RTK:n ollessa solukalvossa, sen N-terminaali on solun ulkopuolella. Solun ulkopuolisessa osassa on vähintään reseptorille ominaisen ligandin sitova proteiinidomeeni, mutta muuten solun ulkopuolinen alue vaihtelee rakenteeltaan eri tyyppisten RTK:iden välillä. Eri RTK-tyypeissä solun ulkopuolisella alueella on kuitenkin usein paljon disulfidisidoksia ja glykosyloituja aminohappoja. RTK:n C-terminaali on solun sisäpuolella. Sisäpuoliseen alueeseen kuuluu proteiinidomeeni, joka toimii tyrosiinikinaasina.[1]
Sitoessaan reseptorin aktivoivan ligandin, RTK:t kiinnittyvät toisiinsa kahden RTK:n pareiksi eli dimeereiksi. RTK:ista riippuen dimeerit voivat koostua samanlaisista tai erilaisista RTK:ista, eli olla vastaavasti homo- tai heterodimeereitä. Jotkin RTK:t voivat olla kiinni toisissaan dimeereinä myös ollessaan inaktiivisia. Kiinnittyminen on usein ei-kovalenttista, mutta jotkin RTK:t, kuten insuliinireseptorit, ovat pysyvästi kiinni toisissaan kovalenttisesti dimeereinä.[4]
Toiminta
Elleivät RTK:t ole jo kiinni toisissaan, aktivoivan ligandin sitoessaan RTK:t liittyvät ei-kovalenttisesti yhteen kahden samanlaisen tai erilaisen RTK:n pareiksi, eli homo- tai heterodimeereiksi. RTK:ihin kuuluvat insuliinireseptorit ovat tosin jo valmiiksi toisissaan kiinni, sillä niissä kiinnittyminen on kovalenttista.[4] Dimeerissä RTK:iden tyrosiinikinaasitoiminta lisääntyy aktivoivan ligandin vaikutuksesta ja RTK:t alkavat tällöin fosforyloimaan solukalvon sisäpuolen tyrosiineja toinen toisistaan kuluttaen näissä reaktioissa ATP:tä ADP:ksi. Erilaiset proteiinit voivat vähentää tyrosiinien fosforylaatiota ja säädellä siten reseptorien kautta välittyviä signaaleita.[1] Fosforyloituvien tyrosiinien määrät riippuvat RTK:sta. Niitä voi olla muutamia tai kymmeniä.[4]
Fosforyloidut tyrosiinit toimivat sitoutumiskohtina erilaisille proteiineille solussa. Sitoutuessaan nämä proteiinit välittävät erilaisia signaaleita eteenpäin solussa monivaiheisten reittien kautta. Signaaleita välittävät eteenpäin esimerkiksi mitogeeniaktivoidut proteiinikinaasit (MAPK), fosfatidyyli-inositoli-3-kinaasit (PI3K) tai CSK-tyrosiiniproteiinikinaasit (Src).[1]
Ligandin sitoutuminen RTK:hon saa lopulta aikaan RTK:n ja sen sitoman ligandin endosytoosin. Tämä pysäyttää reseptorilta välittyvän signaalin. Usein endosytoosi tapahtuu klatriinivälitteisesti, muttei välttämättä. RTK ja sen ligandi päätyvät endosomiin, jossa RTK defosforyloidaan ja ubikinoidaan. Endosomin happamoituminen irrottaa ligandin RTK:sta. RTK voi sitten – RTK-tyypistä riippuen – palata takaisin solukalvolle tai hajota.[2]
Luokittelu
Ainakin vuoteen 2015 mennessä ihmisissä tiedettiin olevan 58 eri RTK:ta. Nämä jaetaan rakenteen perusteella 20:een ryhmään:[1][2]
- I: ErbB-reseptorit (EGFR)
- II: Insuliinireseptori (INSR) ja tyypin 1 IGF-reseptori (IGFR)
- III: Verihiutalekasvutekijäreseptorit (PDGFR)
- IV: VEGF-reseptorit (VEGFR)
- V: Fibroblastikasvutekijäreseptorit (FGFR)
- VI: CCK4
- VII: Hermokasvutekijän reseptorit (TRK-reseptorit)
- VIII: C-met-proto-onkogeeniproteiini ja MST1R (RON)
- IX: Eph-perheen reseptorit (EPHR)
- X: AXL-reseptori tyrosiinikinaasi, TYRO3 ja MERTK
- XI: TIE-reseptorit
- XII: Tyrosiinikinaasin kaltainen reseptori (RYK)
- XIII: Diskoidiini-domeenireseptorit (DDR)
- XIV: RET-proto-onkogeeni
- XV: ROS1
- XVI: Leukosyyttireseptori tyrosiinikinaasi (LTK) ja anaplastiseen lymfoomaan liittyvä kinaasi (ALK)
- XVII: Reseptorityrosiinikinaasin kaltaiset orporeseptorit (ROR)
- XVIII: Lihasspesifinen kinaasi (MuSK)
- XIX: AATYK1, AATYK2 ja AATYK3
- XX: määrittelemätön
Merkitys sairauksissa
RTK:t osallistuvat useiden sairauksien kehittymiseen. Niillä on kuitenkin keskeinen rooli eritoten syöpien kehityksessä. Arviolta 30%:ssa syövistä jossakin RTK:n geenissä on ilmennyt RTK:n toimintaa lisäävä mutaatio (geeni on muuttunut onkogeeniksi) tai RTK:n tuotanto kasvanut liikaa. Siksi on kehitetty syöpälääkkeitä, jotka estävät tiettyjen tyrosiinikinaasireseptorien toimintaa. Eräs esimerkki tällaisesta lääkkeestä on imatinibi, joka estää muun muassa verihiutalekasvutekijäreseptoreita ja C-kit-proto-onkogeeniproteiinia. Muita esimerkkejä ovat dasatanibi, kabotsantinibi, tivantinibi, sediranibi, sunitinibi, sorafenibi, vandetanibi ja lapatinibi.[1]
Lähteet
- AI Ségaliny et al: Receptor tyrosine kinases: characterisation, mechanism of action and therapeutic interests for bone cancers. Journal of Bone Oncology, 2015, 4. vsk, nro 1, s. 1–12. PubMed:26579483. doi:10.1016/j.jbo.2015.01.001. ISSN 2212-1366. Artikkelin verkkoversio.
- MA Lemmon, J Schlessinger: Cell signaling by receptor-tyrosine kinases. Cell, 2010, 141. vsk, nro 7, s. 1117–1134. PubMed:20602996. doi:10.1016/j.cell.2010.06.011. ISSN 0092-8674. Artikkelin verkkoversio.
- Finto: MeSH: reseptorin proteiini-tyrosiinikinaasit finto.fi. Viitattu 27.2.2021.
- IN Maruyama: Mechanisms of activation of receptor tyrosine kinases: monomers or dimers. Cells, 2014, 3. vsk, nro 2, s. 304–330. PubMed:24758840. doi:10.3390/cells3020304. Artikkelin verkkoversio.