Tumareseptorit
Tumareseptorit ovat proteiineja, jotka sopivan molekyylin eli ligandin sidottuaan sitoutuvat tiettyyn kohtaan tuman DNA:ssa vaikuttaen siten tiettyjen geenien transkriptioon lisäävästi tai vähentävästi, jolloin näiden geenien koodaamien proteiinien tuotanto solussa kasvaa tai vähenee. Tumareseptoreita on vain eläimissä, eikä esimerkiksi sienissä, kasveissa tai edes eläimiä sukulaisuussuhteeltaan lähimpänä olevissa kaulussiimaeliössä.[1]
Tumareseptorit poikkeavat muista reseptoreista ainakin kolmessa asiassa. 1. Ne eivät ole kiinni solukalvossa vaan ovat tumassa tai yleensä solulimassa. 2. Tumareseptorien ligandit ovat usein rasvaliukoisia ja ne voivat siksi läpäistä solukalvon. 3. Muiden reseptorien signaalit välittyvät muiden, toisioläheteiksi kutsuttujen, aineiden kautta. Tumareseptorit taas vaikuttavat suoraan kohteeseensa, joka on DNA. Jälkimmäisen eron takia tumareseptorit voidaan reseptorien sijaan pikemminkin mieltää ligandien aktivoimiksi transkriptiotekijöiksi.[2]
Ihmisissä tumareseptoreita on ainakin 48,[1] mutta silmukoitumisen takia kustakin voi olla useita muotoja eli isoformeja.[2] Estrogeenireseptorit ovat esimerkki ihmisten tumareseptoreista. Niiden tärkein sisäsyntyinen ligandi on estradioli.[1][3] Ne olivat myös ensimmäiset tunnistetut tumareseptorit. Niiden olemassaolo tunnistettiin vuonna 1962.[1] Ihmisissä muun muassa myös androgeenit, kilpirauhashormonit, D-vitamiinit ja A-vitamiinit saavat aikaan ainakin osan vaikutuksistaan tumareseptorien kautta.[2]
Rakenne

Alla: DNA:han sinkkisormista kiinnittynyt tumareseptori. Rakenteesta puuttuvat domeenit on esitetty katkoviivoin. Punainen katkoviiva: N-terminaalinen domeeni. Sininen: DNA:ta sitova domeeni. Pinkki katkoviiva: saranadomeeni. Vihreä: ligandia sitova domeeni (punainen on ligandi). Oranssi katkoviiva: C-terminaalinen domeeni.
Tumareseptorit ovat suoria peptidiketjuja, kuten proteiinit yleensäkin. Ketjun alueet voidaan jakaa viiteen osaan eli proteiinidomeeniin:[2]
- N-terminaalinen domeeni eli NTD. Monista tumareseptoreista on monia eri muotoja eli isoformeja, jotka muodostuvat NTD:n silmukoitumisen kautta. NTD:ssä on aktivaatiofunktio 1- eli AF1-alue. Alue sitoo sopivia transkriptiotekijöitä, jotka vaikuttavat tumareseptorin toimintakykyyn sen sitomasta ligandista riippumattomasti.[2]
- DNA:ta sitova domeeni eli DBD (eng. DNA-binding domain), jossa on kaksi sinkkisormi-proteiinimotiivia. Alue kiinnittyy sinkkisormien avulla tiettyihin alueisiin DNA:ssa, joita kutsutaan hormonivaste-elementeiksi eli HRE (eng. hormone response element). DBD on hyvin samanlainen eri tumareseptorien välillä eli se on konservoitunut.[2]
- saranadomeeni. Tästä taipuisasta alueesta tumareseptori voi sitoutua toiseen tumareseptoriin, jolloin reseptorit tuottavat dimeerin.[2]
- ligandin sitova domeeni eli LBD (eng. ligand binding domain). LBD:ssä on ligandin sitova kohta, jota sanotaan aktivaatiofunktio 2:ksi eli AF2:ksi.[2]
- C-terminaalinen domeeni.[2]
Tumareseptorit voivat olla aktiivisia eli vaikuttaa DNA:han sitoutumalla siihen joko yksistään eli monomeereinä tai pareittain eli dimeereinä. Dimeerit voivat olla homodimeereitä tai heterodimeereitä (katso: proteiinien kvaternäärirakenne).[3]
Luokittelu
Tumareseptorit voivat olla aktiivisia eli vaikuttaa DNA:han sitoutumalla siihen joko yksistään tai pareittain. Reseptorien sitomien DNA-alueiden emäsjärjestys eli sekvenssi on tietynlainen. Näitä sekvenssejä kutsutaan hormonivaste-elementeiksi (HRE). Jos reseptorit ilmenevät pareittain, HRE-sekvenssejäkin on kaksi. Jos sekvenssit ovat osin samanlaiset, voivat samanlaiset alueet olla DNA:ssa perättäin symmetrisesti, jolloin toista sekvenssiä sanotaan suoraksi toistosekvenssiksi (eng. direct repeat) ja toista käänteistoistosekvenssiksi (eng. inverted repeat). Muussa tapauksessa molemmat sekvenssit ovat suoria toistosekvenssejä.[3]
Mangelsdorfin ja kollegoiden vuonna 1995 ehdottama tumareseptorien luokittelu pohjautuu osin edellä esiteltyihin käsitteisiin. Tätä luokittelua käytetään laajalti ja siinä on neljä luokkaa, jotka on esitelty alla.[4][5][2][3]
Luokka I
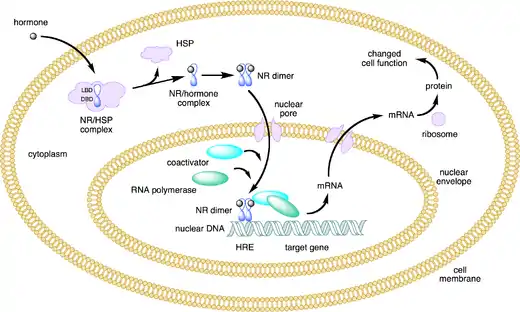
Luokan I reseptorit eli steroidireseptorit ovat aktiivisia keskenään samanlaisina reseptoripareina eli homodimeereinä. Reseptoreista toinen sitoutuu DNA:ssa suoraan toistosekvenssiin ja toinen käänteistoistosekvenssiin.[4]
Ihmisissä luokkaan I kuuluvat muun muassa (suluissa ovat reseptorien tärkeimmät sisäsyntyiset ligandit):
- AR eli androgeenireseptori (dihydrotestosteroni ja testosteroni)[2][3]
- ER eli estrogeenireseptorit α ja β (estradioli)[1][3]
- PR eli progesteronireseptori (progesteroni)[3]
- GR eli glukokortikoidireseptori (glukokortikoidit)[3]
- MR eli mineralokortikoidireseptori (aldosteroni)[2]
Luokka II
Luokan II reseptorit eli RXR heterodimeerit ovat aktiivisia keskenään erilaisina reseptoripareina eli heterodimeereinä. Reseptoreista toinen on aina retinoidi-X-reseptori eli RXR ja toinen on jokin muu tumareseptori. Reseptoreista molemmat sitoutuvat yleensä suoriin toistosekvensseihin, mutta joskus toinen sekvensseistä on käänteistoistosekvenssi.[4]
Luokan II reseptoreissa toinen tumareseptori vaatii aktiivisuuteen RXR:n. Yksittäinen RXR taas voi muodostaa toisen RXR:n kanssa homodimeerin, joka on aktiivinen eli se voi vaikuttaa DNA:han.[3] Luokan II reseptorit voivat olla toiminnaltaan sallivia (eng. permissive), jolloin dimeerin aktivaatioon riittää se, että se vain toinen dimeerin reseptoreista sitoo ligandin. Jos molempien tulee sitoa ligandi samanaikaisesti, on dimeeri ei-salliva (eng. non-permissive).[2]
Ihmisissä luokkaan II kuuluvat muun muassa (suluissa ovat reseptorien tärkeimmät sisäsyntyiset ligandit):
- RXR:t eli retinoidi-X-reseptorit α, β ja γ (alitretinoiini)[1]
- RAR:t eli retinoiinihapporeseptorit α, β ja γ (tretinoiini tai alitretinoiini)[1]
- TR:t eli kilpirauhashormonireseptorit α ja β (trijodityroniini ja tyroksiini)[1][2]
- PPAR:t eli peroksisomien proliferaattoriaktivoidut reseptorit α, β, γ ja δ (rasvahapot ja prostaglandiinit)[1][2]
- CAR eli konstitutiivinen androstaanireseptori (androstaani)[1][2]
- PXR eli pregnaani-X-reseptori (monet keholle vieraat aineet eli ksenobiootit)[1][2]
- VDR eli D-vitamiinireseptori (kalsitrioli)[1]
Luokka III
Luokan III reseptorit eli dimeeriset orvot reseptorit ovat dimeereitä ja yleensä homodimeereitä. Yleensä reseptoreista molemmat sitoutuvat suoriin toistosekvensseihin.[4] Nämä eroavat luokan I ja II reseptoreista siten, että niille ei ole tunnistettu ligandia, jonka takia niitä kutsutaan orvoiksi.[3]
Luokka IV
Luokan IV reseptorit eli monomeeriset orvot reseptorit ovat ligandiltaan tuntemattomia luokan III reseptorien tapaan, mutta luokan IV reseptorit ovat monomeerejä.[4]
Lähteet
- GI Mazaira et al: The nuclear receptor field: a historical overview and future challenges. Nuclear receptor research, 2018, 5. vsk. PubMed:30148160. doi:10.11131/2018/101320. ISSN 2314-5706. Artikkelin verkkoversio.
- HP Rang et al: Rang and Dale's pharmacology, s. 43-45. 8. painos. Elsevier, 2016. ISBN 9780702053627.
- BA Porter et al: Structure and function of the nuclear receptor superfamily and current targeted therapies of prostate cancer. Cancers, 2019, 11. vsk, nro 12. PubMed:31771198. doi:10.3390/cancers11121852. ISSN 2072-6694. Artikkelin verkkoversio.
- DJ Mangelsdorf et al: The nuclear receptor superfamily: the second decade. Cell, 1995, 83. vsk, nro 6, s. 835–839. PubMed:8521507. ISSN 0092-8674. Artikkelin verkkoversio.
- JM Olefsky: Nuclear receptor minireview series. The Journal of Biological Chemistry, 2001, 276. vsk, nro 40, s. 36863–36864. PubMed:11459855. doi:10.1074/jbc.R100047200. ISSN 0021-9258. Artikkelin verkkoversio.