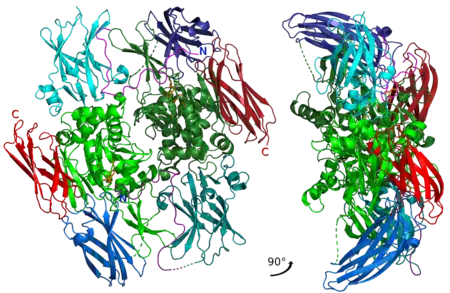
Tekijä XIII
Hyytymistekijä XIII on ihmisten ja monien muiden eläinten veressä oleva inaktiivinen tsymogeeni. Se katkeaa aktiiviseksi tekijäksi XIIIa, joka on osa veren hyytymistä. Monista hyytymistekijöistä poiketen XIIIa on transglutaminaasi. Se tuottaa verkkosidoksia verihyytymän muodostavien fibriinien välille. Sidokset vahventavat hyytymää. XIII tunnetaan myös nimellä fibriiniä stabiloiva tekijä.[1]
| Tekijä XIII, A1-polypeptidi | |
| Tunnisteet | |
| EC-numero | 2.3.2.13 |
| Tietokannat | |
| KEGGt | KEGG |
| Entrez | 2162 |
| OMIM | 134570 |
| UniProt | P00488 |
| Tekijä XIII, B-polypeptidi | |
| Tunnisteet | |
| Tietokannat | |
| Entrez | 2165 |
| OMIM | 134580 |
| UniProt | P05160 |
Tarkemmin ottaen XIII:t koostuvat kahden XIIIA-entsyymin ja kahden ei-entsymaattisen XIIIB-proteiinin (näiden geenit ovat F13A1 ja F13B vastaavasti) yhdistelmistä eli ne ovat heterotetrameerejä (XIIIA2B2). Näiden XIIA:t aktivoituvat trombiinien avulla, jolloin XIIIB:t irtoavat. Jäljelle jääneet XIIIA2-homodimeerit katalysoivat verkkosidosten muodostusta. Myös XIIIA2- ja XIIIB2-dimeereitä ilmenee kehossa eri kudoksissa, mutta nämä eivät tiettävästi osallistu hyytymiseen.[1]
Geenit
Ihmisillä XIIIA:n geeni on F13A1. Se on kromosomissa 6 kohdassa 6p24–25. Sen pituus on noin 160 kiloemäsparia (kbp). Siinä on 14 intronia ja 15 eksonia. mRNA on 3.9 kbp, jossa on 84 bp 5' transloitumaton alue (5' UTR) ja 1.6 kbp 3' transloitumaton alue.[1]
F13A1-geenin eksoneista osa koodaa samoja proteiinidomeeneja. Eksoni(t) numero
- 1 koodaa 5' transloitumatonta aluetta[1]
- 2 koodaa aktivaatiopeptidiä[1]
- 2–4 koodaavat β-voileipädomeenia[1]
- 4–12 koodaavat aktiivisen kohdan omaavaa domeenia[1]
- 12–13 koodaavat β-tynnyridomeenia 1[1]
- 13–15 koodaavat β-tynnyridomeenia 2[1]
Ihmisillä XIIIB:n geeni on F13B. Tämä on kromosomissa 1 kohdassa 1q31–32.1. Sen pituus on noin 28 kbp. Siinä on 11 intronia ja 12 eksonia. mRNA on 2.2 kbp. Eksoni 1 koodaa 5' transloitumatonta aluetta ja eksonit 2–12 koodaavat kymmentä eri sushidomeenia.[1]
Rakenteet
Ihmisillä XIIIA:n massa on noin 83 kDa ja siinä on 731 aminohappoa. Se koostuu 4:stä proteiinidomeenista (suluissa aminohappojen numerot N-terminaalista lukien):[1]
- aktivaatiopeptidi (1–37)[1]
- β-voileipädomeeni (38–184)[1]
- aktiivinen kohta (185–515), jossa C314, H373, D396 ja W279 osallistuvat katalyysiin[1]
- β-tynnyri 1 (516–628)[1]
- β-tynnyri 1 (629–731)[1]
Ihmisillä XIIIB on glykoproteiini. Sen massa on noin 80 kDa, josta 8.5 % on hiilihydraateista. Siinä on 641 aminohappoa. Siinä on 10:n samankaltaista domeenia, joita kutsutaan sushi- tai GP-I-domeeneiksi. Kussakin on noin 60 aminohappoa ja 2 sisäistä disulfidisidosta.[1]
XIIIA ja XIIIB tuottavat vereen XIIIA2B2-heterotetrameerejä, jotka osallistuvat veren hyytymiseen. Tetrameerissä XIIB:t ympäröivät kehämäisenä rakenteena keskiössä olevaa XIIA-dimeeriä. Veressä on myös paljon ei-entsymaattisia XIIIB-monomeerejä. Verihiutaleiden ja tiettyjen muiden solujen solulimassa on XIIIA2-homodimeereitä, mutta nämä eivät osallistu hyytymiseen.[1]
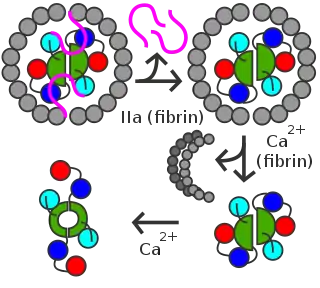
Kun tekijä XIII aktivoituu XIIIa:ksi, kustakin XIIIA:sta katkeaa niiden R37–G38 välinen peptidisidos trombiinin vaikutuksesta. Tällöin aktivaatiopeptidi poistuu kustakin.[1]
Toiminta
Ihmisillä XIIIA:t muodostuvat pääosin luuytimessä ja XIIIB:t maksassa. Nämä proteiinit päätyvät vereen ja tuottavat tetrameerisiä XIIIA2B2-komplekseja, joiden pitoisuus veriplasmassa on 14–28 mg/l[1] ja puoliintumisaika 9–14 vrk.[2]
Veressä XIIIA2B2 juuttuu fibriinihyytymään, jossa veren trombiini aktivoi sen. Veren kalsiumin läsnä ollessa XIIIB:t poistuvat. Jäljelle jää aktivoitu XIIIA2-dimeeri, joka tuottaa fibriinien välille verkkosidoksia hyytymää siten vahvistaen. Entsyymi on transglutaminaasi, joten se tuottaa eri fibriinien lysiinien ja glutamiinien välille niitä yhteen liittäviä isopeptidisidoksia.[1]
Aktivoitu dimeeri inaktivoituu hajoamalla proteolyyttisesti esimerkiksi plasmiinin, antitrombiinin tai kudostekijätien estäjän (TFPI) avulla. Ei-proteolyyttinen estäjä on α2-makroglobuliini.[1]
Mutaatiot
Tekijän XIII puutos johtuu joko XIIIA:ta tai XIIIB:tä koodaavien geenien mutaatioista, jotka heikentävät XIII:n toimintakykyä. Molemmat periytyvät autosomaalisesti ja resessiivisesti. Mutaatiot aiheuttavat verenvuototaudin. Mutaatiotyyppejä tunnetaan useita ja niistä johtuva puutos luokitellaan XIIIA:n tai XIIIB:n puutokseksi. Näistä edeltävällä on 2 alatyyppiä: tyypin 1 puutos johtuu XIIIA:n toiminnan heikkoudesta ja tyypin 2 niiden vähäisestä lukumäärästä. Joskus puutos johtuu epäsuorista tekijöistä kuten autoimmuunisairauksista tai lääkkeistä – nämä tekijät lisäävät XIIIA:n ja/tai XIIIB:n kulutusta tai vähentävät niiden tuottoa.[2]
Mutaatioperäiset XIII:n puutokset ovat usein vakavampia kuin muissa perinnöllisissä verenvuototaudeissa. XIII-mutaatiot aiheuttavat vakavimmillaan verenvuotoa jo pian syntymän jälkeen, sillä noin 57 %:lla ilmenee runsasta verenvuotoa napanuoran leikkauskohdasta. Yleisiä oireita ovat muun muassa ihonalaiset, lihasten sisäiset ja pääkallon sisäiset verenvuodot. Puutoksessa ilmenee lievän ja vakavan verenvuodon jaksoja. Kuolleisuus on perinnöllistä puutosta potevilla usein suurta eritoten pään sisäisten verenvuotojen takia. Leikkausten yhteydessä voi ilmetä vakavaa verenvuotoa. Keskenmenon todennäköisyys on puutosta potevilla jopa 80 %.[2]
Lähteet
- L Muszbek et al: Factor XIII: a coagulation factor with multiple plasmatic and cellular functions. Physiological Reviews, 2011, 91. vsk, nro 3, s. 931–972. PubMed:21742792. doi:10.1152/physrev.00016.2010. ISSN 0031-9333. Artikkelin verkkoversio.
- Z Fadoo, Q Merchant, KA Rehman: New developments in the management of congenital factor XIII deficiency. Journal of Blood Medicine, 2013, 4. vsk, s. 65–73. PubMed:23761984. doi:10.2147/JBM.S32693. ISSN 1179-2736. Artikkelin verkkoversio.