Sumatriptaani
Sumatriptaani on triptaani. Sitä käytetään lääkkeenä muun muassa Suomessa äkillisen migreenin hoitoon lähinnä tabletteina 50 tai 100 mg annoksin[3] ja myös sarjoittaisen päänsäryn hoitoon itse ihon alle injektioneulalla pistetyin 6 mg annoksin.[4][5] Sumatriptaania myydään Suomessa valmistenimillä Imigran, Oriptan ja Sumatriptan tabletteina, nenäsumutteena ja injektionesteenä.[6]
 | |
Sumatriptaani | |
| Systemaattinen (IUPAC) nimi | |
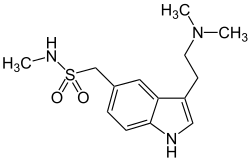
| 3-(2-(Dimetyyliamino)etyyli)-N-metyyli-1H-indoli-5-metaanisulfonamidi | |
| Tunnisteet | |
| CAS-numero | |
| ATC-koodi | N02 |
| PubChem | |
| DrugBank | |
| Kemialliset tiedot | |
| Kaava | C14H21N3O2S |
| Moolimassa | 295.402 g/mol |
| Farmakokineettiset tiedot | |
| Hyötyosuus | 14% nieltynä, 96% pistoksena ihon alle[1] |
| Proteiinisitoutuminen | 14-21%[2] |
| Metabolia | MAO-A[2] |
| Puoliintumisaika | 2.5 h[2] |
| Ekskreetio | 60% virtsa, 40% uloste[2] |
| Terapeuttiset näkökohdat | |
| Raskauskategoria |
C(US) |
| Reseptiluokitus |
|
| Antotapa | nieltynä, ihonalaispistoksena, nenäsumutteena[2] |
Suomessa sumatriptaanin ostaminen itsehoitolääkkeenä eli ilman reseptiä on ollut mahdollista 2016 alkaen, mutta lääkkeen saanti reseptittä vaatii, että lääkäri on joskus todennut migreenin. Lääkkeen voi hätätapauksessa saada myös vanhentuneella reseptillä jos se on sähköinen resepti ja enintään 6 kuukautta sitten vanhentunut.[7][8]
Lääke tuli ensimmäisen kerran myyntiin 1991 USA:ssa, sittemmin muissa maissa, ja aluksi vain ihonalaispistoksin käytettävässä muodossa.[9]
Käyttö
Tabletti toimii migreenin hoidossa tehokkaimmin kun se otetaan heti migreenin oireiden ilmettyä. Viivästely voi hidastaa lääkkeen kipua lievittävää vaikutusta. 50 mg tabletit lievittävät kivun noin 30%:lla käyttäjistä alle kahdessa tunnissa. Myös ihonalaispistoksia käytetään migreeniin ja 6 mg pistoksin päänsärky lievittyy noin 60%:lla alle kahdessa tunnissa.[10]
Sarjoittaiseen päänsärkyyn lääke tehoaa ihon alle pistettynä nopeasti ja 6 mg annoksena se voi lievittää kivun alle 30 minuutissa 77%:lla käyttäjistä.[11]
Huomiot
Sumatriptaani ei toimi hoitona hemiplegiseen- tai harvinaiseen basilaariseen migreeniin.[2]
Lääkkeen käyttö ei ehkä ole turvallista jos potee tai on potenut joitain verenkiertosairauksia, kuten korkeaa verenpainetta, angina pectorista tai on saanut joskus aivohalvauksen. Käyttö voi nimittäin kohottaa riskiä saada jokin verenkierron häiriö. Myös pelkät viitteet joistain verenkiertosairauksista ja vakavasti maksan toimintaa heikentävät sairaudet voivat estää lääkkeen turvallisen käytön.[2]
Lääke kuuluu USA:ssa raskauskategoriaan C eli sen vaikutusta sikiön kehitykseen raskaudessa ei ole tutkittu kylliksi. Lääkettä kannattaa siis käyttää raskaana vain silloin kun käytön mahdolliset hyödyt ovat haittoja suuremmat.[2]
SSRI- ja SNRI-masennuslääkkeiden ja muiden triptaanien kanssa käytettynä sumatriptaani voi aiheuttaa serotoniinioireyhtymän. Koska aine muuntuu MAO-A-entsyymillä ei-aktiiviseen muotoon, voivat MAO-A:ta salpaavat MAO-estäjät voimistaa lääkkeen vaikutusta vaarallisesti. Sumatriptaania ei siksi tule käyttää jos viimeisen kahden viikon sisällä on käyttänyt MAO-estäjiä. Ergotamiinia tai sen kaltaisia lääkkeitä (mm. metysergidi, dihydroergotamiini) voi käyttää vasta kuuden tunnin kuluttua sumatriptaanin käytöstä, sillä nämä kaikki supistavat suonia ja tämä vaikutus voi yhteiskäytössä olla haitallisen voimakasta.[2] Mäkikuismaa ei tule myöskään käyttää samanaikaisesti sumatriptaanin kanssa.[3]
Sivuvaikutukset
Yleisiä sivuvaikutuksia, joita tulee noin 5%:lle käyttäjistä, ovat kihelmöinti, kuumat ja kylmät tuntemukset iholla sekä kipu tai paineen tunne. Noin 1%:lla käyttäjistä on rintakipua, leuka-, pää- tai niskajäykkyyttä sekä väsymystä. Alle 1%:lla on huimausta. Sivuvaikutukset voimistuvat annoskoon kasvaessa.[2]
Harvinaisissa tapauksissa verenpaine voi kohota lääkettä käytettäessä merkittävästi, jopa niillä, keillä ei aiemmin ole ollut verenpaineongelmia.[2]
Sumatriptaanin ja muiden migreenilääkkeiden (ergotamiini, opioidit, muut triptaanit) pitkäaikainen käyttö runsain annoksin voi aiheuttaa näiden lääkkeiden aikaansaamaa päänsärkyä.[2]
Sumatriptaanin rikki voi sitoutua hemoglobiiniin, jolloin veri värjäytyy vihreäksi käytettäessä lääkettä runsain annoksin. Tilaa kutsutaan sulfhemoglobinemiaksi. Värjäytyminen on väliaikaista ja loppuu muutamassa viikossa lääkkeen käytön lopettamisesta.[12]
Vaikutusmekanismi
Rakenteeltaan serotoniinin kanssa samankaltainen sumatriptaani on serotoniinireseptorien 5-HT1D ja 5-HT1B agonisti. Sumatriptaanin lääkevaikutus johtuu sen kyvystä estää kalsitoniini-geeniin liittyvää peptidiä (CGRP) todennäköisesti sen 5-HT1D/1B agonismin kautta. Tapa, jolla 5-HT1D/1B agonismi estää CGRP:n vapautumista, on kuitenkin tuntematon.[13]
Epäillään, että CGRP herkistää kolmoishermon kipua aistivia soluja, voimistaen siten migreenin aikana koettua kipua.[14] GCRP:tä pidetään nykyään keskeisenä migreenin osatekijänä, eivätkä sairaudessa havaittavat verenkiertohäiriöt aiheuta sairauden kipua, vaan ovat vain sen mahdollinen sivuoire. On siis todennäköistä että CGRP-välitteinen vaikutus sumatriptaanilla on sen ainoa merkittävä vaikutustapa, ja esim. sen vaikutukset verisuonistoon ovat olemattomat migreenin hoidossa. CGRP:n ja CGRP-reseptorien suorat estäjät nimittäin toimivat tehokkaina uudenlaisina migreenilääkkeinä vaikuttamatta verisuonistoon. Näitä lääkkeitä ovat monoklonaaliset vasta-aineet kuten kokeellinen Galcanezumab.[15]
Katso myös
- Psilosybiini, sumatriptaanin kaltainen psykedeelinen sieniperäinen alkaloidi
Lähteet
- AK Scott: Sumatriptan clinical pharmacokinetics. Clinical Pharmacokinetics, 1994, 27. vsk, nro 5, s. 337–344. PubMed:7851052. doi:10.2165/00003088-199427050-00002. ISSN 0312-5963. Artikkelin verkkoversio.
- IMITREX® (sumatriptan succinate) Tablets dailymed.nlm.nih.gov. Arkistoitu 31.7.2018. Viitattu 31.7.2018.
- IMIGRAN RADIS tabletti, kalvopäällysteinen 50 mg, 100 mg laakeinfo.fi. Arkistoitu 27.12.2017. Viitattu 1.8.2018.
- Sari Atula: Sarjoittainen päänsärky Duodecim. 25.5.2015. Arkistoitu 13.8.2017. Viitattu 1.8.2018.
- IMIGRAN injektioneste, liuos 12 mg/ml laakeinfo.fi. Viitattu 1.8.2018.
- Ihmisille tarkoitettujen lääkevalmisteiden valmisteyhteenvedot ATC-koodin perusteella: N02CC01 Fimea.
- Suositus - Käypä hoito kaypahoito.fi. 2016. Suomalainen Lääkäriseura Duodecim. Arkistoitu 12.7.2017. Viitattu 1.8.2018.
- Piia Kujala: Suosittu migreenilääke loppui taas tukusta – ”Mikään apteekki ei sitä saa” Ilta-Sanomat. 13.4.2018. Viitattu 1.8.2018.
- Jenny Bryan: How sumatriptan transformed the lives of millions of migraine sufferers Pharmaceutical Journal. 19.3.2010. Arkistoitu 31.7.2018. Viitattu 31.7.2018.
- CJ Derry, S Derry, RA Moore: Sumatriptan (all routes of administration) for acute migraine attacks in adults - overview of Cochrane reviews. The Cochrane Database of Systematic Reviews, 2014, 28. vsk, nro 5, s. CD009108. PubMed:24865446. doi:10.1002/14651858.CD009108.pub2. ISSN 1469-493X. Artikkelin verkkoversio.
- Treatment of acute cluster headache with sumatriptan. The Sumatriptan Cluster Headache Study Group. The New England Journal of Medicine, 1991, 325. vsk, nro 5, s. 322–326. PubMed:1647496. doi:10.1056/NEJM199108013250505. ISSN 0028-4793. Artikkelin verkkoversio.
- AM Flexman, G Del Vicario, SKW Schwarz: Dark green blood in the operating theatre. The Lancet, 2007, 369. vsk, nro 9577, s. 1972. PubMed:17560450. doi:10.1016/s0140-6736(07)60918-0. ISSN 0140-6736. Artikkelin verkkoversio.
- LD Baillie, AH Ahn, SJ Mulligan: Sumatriptan inhibition of N-type calcium channel mediated signaling in dural CGRP terminal fibres. Neuropharmacology, 2012, 63. vsk, nro 3, s. 362–367. PubMed:22691374. doi:10.1016/j.neuropharm.2012.04.016. ISSN 0028-3908. Artikkelin verkkoversio.
- R Giniatullin, A Nistri, E Fabbretti: Molecular mechanisms of sensitization of pain-transducing P2X3 receptors by the migraine mediators CGRP and NGF. Molecular Neurobiology, 2008, 37. vsk, nro 1, s. 83–90. PubMed:18459072. doi:10.1007/s12035-008-8020-5. ISSN 0893-7648. Artikkelin verkkoversio.
- AR Tso, PJ Goadsby: Anti-CGRP Monoclonal Antibodies: the Next Era of Migraine Prevention?. Current Treatment Options in Neurology, 2017, 19. vsk, nro 8. PubMed:28653227. doi:10.1007/s11940-017-0463-4. ISSN 1092-8480. Artikkelin verkkoversio.
Aiheesta muualla
- PubChem: Sumatriptan (englanniksi)
- Human Metabolome Database (HMDB): Sumatriptan (englanniksi)
- DrugBank: Sumatriptan (englanniksi)
- Kyoto Encyclopedia of Genes and Genomes (KEGG): Sumatriptan (englanniksi)
- ChemBlink: Sumatriptan (englanniksi)