Sulfolaani
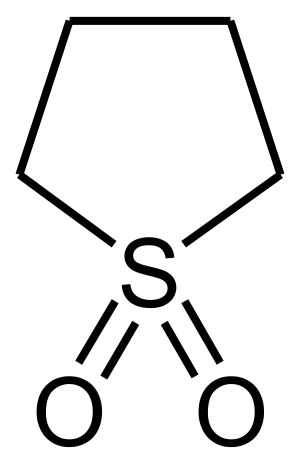
Sulfolaani (C4H8SO2) on heterosyklisiin sulfoneihin kuuluva orgaaninen yhdiste. Yhdistettä käytetään laajasti kemianteollisuudessa liuottimena muun muassa uutoissa.
| Sulfolaani | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | |
| IUPAC-nimi | Tiolaani-1,1-dioksidi |
| SMILES | C1CCS(=O)(=O)C1[1] |
| Ominaisuudet | |
| Kemiallinen kaava | C4H8SO2 |
| Moolimassa | 120,174 g/mol |
| Tiheys | 1,261[2] g/cm³ |
| Sulamispiste | 27 °C[2] |
| Kiehumispiste | 285 °C[2] |
| Liukoisuus | Liukenee veteen |
Ominaisuudet
Huoneenlämpötilassa puhdas sulfolaani on kellertävän valkoista kiteistä ainetta. Yhdiste liukenee hyvin veteen, asetoniin ja tolueeniin ja hieman heikommin alkaaneihin, alkeeneihin ja naftaleeniin. Veden määrällä sulfolaanin joukossa on huomattava vaikutus sulamispisteeseen. Esimerkiksi 2 % vettä sisältävän sulfolaanin sulamispiste on noin 10 °C. Yhdiste on voimakkaasti polaarinen. Sulfolaani on suhteellisen inertti ja reagoimaton liuotin. UV-säteilyn alaisuudessa se reagoi halogeenien kanssa halogenoiduiksi johdannaisiksi ja natriumin tai kaliumin tolueeniliuokset avaavat rengasrakenteen, jolloin muodostuu bis-1,8-oktaanisulfinaattisuoloja. Sulfolaani muodostaa komplekseja eräiden Lewis-happojen kuten booritrifluoridin ja fosforipentafluoridin kanssa.[2][3][4][5]
Valmistus ja käyttö
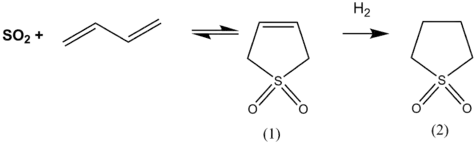
Sulfolaania valmistetaan butadieenin ja rikkidioksidin välisellä keletrooppisella reaktiolla. Tässä reaktiossa muodostuu tuotteena sulfoleenia, joka pelkistetään katalyyttisesti vedyttämällä sulfolaaniksi.[3][6]
Sulfolaania käytetään huomattavia määriä liuottimena sen alhaisen hinan, korkean kiehumispisteen ja vähäisen myrkyllisyyden vuoksi. Yksi tärkeimpiä käyttökohteita on öljynjalostuksessa aromaattisten hiilivetyjen selektiivinen uutto aromaattisia ja alifaattisia hiilivetyjä sisältävistä seoksista. Sulfolaanin kiehumispiste on riittävän korkea, jotta aromaattiset hiilivedyt voidaan erottaa siitä tislaamalla. Yhdistettä käytetään myös yhdessä di-isopropanoliamiinin kanssa happamien kaasujen poistoon polttokaasuvirroista, polymeerien kuten polyakryylinitriilin ja polyvinyylikloridin liuottimena, liuottamaan rasvahappoja ja niiden estereitä, reaktioiden liuottimena ja liuottimena litiumioniakuissa.[2][3][6][5]
Lähteet
- Sulfolane – Substance summary PubChem. NCBI. Viitattu 21.2.2016.
- Alén, Raimo: Kokoelma orgaanisia yhdisteitä: Ominaisuudet ja käyttökohteet, s. 926. Helsinki: Consalen Consulting, 2009. ISBN 978-952-92-5627-3.
- Earl Clark: Sulfolane and Sulfones, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2000. Viitattu 21.2.2016
- Susan Budavari (päätoim.): Merck Index, s. 1532. 12th Edition. Merck & Co., 1996. ISBN 0911910-12-3. (englanniksi)
- Nicholas P. Cheremisinoff: Industrial Solvents Handbook, s. 93. CRCPress, 2003. ISBN 9780203911334. Kirja Googlen teoshaussa (viitattu 21.2.2016). (englanniksi)
- Hillis O. Folkins: Benzene, Ullmann’s Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2000. Viitattu 21.2.2016