SDS-PAGE
SDS-PAGE (engl. Sodium Dodecyl Sulfate Polyacrylamide Gel Electroforesis) eli natriumdodekyylisulfaattipolyakryyliamidigeelielektroforeesi on biokemiassa, genetiikassa ja molekyylibiologiassa käytetty tekniikka, jolla erotellaan proteiineja niiden elektroforeettisen liikkuvuuden mukaan (liikkuvuuteen vaikuttavat polypeptidin pituus ja molekyylipaino, sähköinen varaus, proteiinin laskostuminen, translaation jälkeiset muokkaukset sekä muut tekijät). Nimi "SDS-PAGE" tulee metodin englanninkielisestä nimestä.
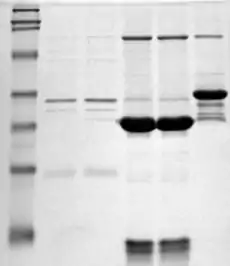
Menetelmä
Analysoitava proteiiniliuos sekoitetaan ensin SDS:ään, joka on anioninen detergentti eli pesuaine. SDS tuhoaa proteiinien sekundaari- ja tertiäärirakenteen ja varaa proteiinit negatiivisesti suhteessa kunkin proteiinin massaan. SDS myös suoristaa proteiinit ja saa ne erottumaan geelillä niiden molekyylipainon mukaan (johon vaikuttaa proteiinin primaarirakenne eli aminohappojen lukumäärä ja koko). Ilman SDS:ää molekyylipainoltaan samanlaiset mutta laskosrakenteeltaan poikkeavat proteiinit etenisivät geelillä eri tavalla niiden erilaisesta laskostumisesta johtuen. Yhtä grammaa proteiinia kohden sitoutuu noin 1,4 grammaa SDS:ää. Suhde voi myös vaihdella 1,1–2,2 g SDS/g proteiinia. Useimpien proteiinien massa/varaus-suhde on suurin piirtein yhtenäinen, eli proteiinin geelillä vaeltaman matkan voidaan olettaa olevan suoraan verrannollinen proteiinin kokoon. Proteiiniliuokseen saatetaan lisätä väriainetta, jotta proteiinin etenemistä geelillä pystytään tarkkailemaan elektroforeesiajon aikana.
Pelkistävä SDS-PAGE
Proteiinin tertiääri- ja kvaternäärirakenteen hajottamiseksi proteiineja voidaan joskus SDS:n käyttämisen lisäksi kuumentaa hetken lähellä kiehumispistettä pelkistimen läsnä ollessa. Pelkistimiä ovat esimerkiksi DTT ja 2-merkaptoetanoli, jotka denaturoivat proteiinia lisää pelkistämällä disulfidisidoksia. Tätä useimmin käytettyä menetelmää kutsutaan pelkistäväksi SDS-PAGE:ksi.
Ei-pelkistävää SDS-PAGE:a (ei kiehuvaa vettä tai pelkistintä) saatetaan käyttää, jos proteiinin luonnollinen rakenne on olennainen jatkoanalyysien kannalta (esimerkiksi tutkittaessa entsyymin aktiivisuutta, jolloin käytetään zymogrammia). Esimerkiksi (QPNC-PAGE) on uusi menetelmä, jolla erotellaan metalloproteiineja monimutkaisista biologisista näytteistä.
Elektroforeesi ja värjäys

Denaturoidut proteiinit siirretään polyakryyliamidigeelin toiseen päähän sopivaan puskuriin. Geeliin johdetaan sähkövirtaa, jolloin negatiivisesti varautuneet proteiinit vaeltavat geelin poikki. Proteiinit vaeltavat eri tavalla riippuen niiden koosta: lyhyet proteiinit mahtuvat helpommin geelin huokosten läpi, kun taas suurempien proteiinien eteneminen on hitaampaa (niihin kohdistuu enemmän resistanssia). Sopivan ajan kuluttua (yleensä muutama tunti, joskin aika riippuu jännitteestä; proteiinit liikkuvat nopeammin korkeassa jännitteessä, mutta silloin erottelukyky on usein huonompaa), proteiinit ovat vaeltaneet geelillä kokonsa mukaan: pienemmät ovat kauempana ja suuremmat lähempänä lähtöpistettään. Näin proteiinit erottuvat karkeasti kokonsa (ja siten molekyylipainonsa) mukaan. Elektroforeesin jälkeen geeli voidaan värjätä (useimmiten Coomassie Brilliant Blue- tai hopeavärillä), jolloin proteiinit näkyvät geelillä tai tulosta voidaan käyttää jatkokokeissa (esimerkiksi Western-blot-analyysissa). Värjäyksen jälkeen proteiinit näkyvät geelillä erillisinä raitoina eli bändeinä (engl. band). Usein geelillä ajetaan myös merkkiproteiineja eli markkereita, joiden molekyylipaino tunnetaan. Merkkiproteiinien avulla geeli voidaan kalibroida ja tuntemattomien proteiinien molekyylipaino määrittää vertaamalla niiden kulkemia etäisyyksiä merkkiproteiinin kulkemaan matkaan.
Geelielektroforeesia käytetään yleensä ensimmäisenä proteiinipuhdistuksessa, koska se on luotettava ja helppo menetelmä. SDS ja denaturoituminen mahdollistavat proteiinien erottelun vain koon perusteella. Väärät negatiiviset ja positiiviset ovat mahdollisia. Mukaan päässyt epäpuhtaus voi näkyä samana raitana geelillä kuin haluttu proteiini. Epäpuhtaus voi aiheuttaa myös proteiinin vaeltamisen väärään sijaintiin tai estää proteiinin tunkeutumisen geeliin. Siksi onkin tärkeää värjätä koko geeli mukaan lukien kaivot, joihin proteiini aluksi asetetaan. Coomassie blue -väri sitoutuu heikommin glykoproteiineihin ja kuitumaisiin proteiineihin, mikä vaikuttaa proteiinimäärän arviointiin[1].
Puskurijärjestelmät
Proteiinit erotellaan yleensä "epäjatkuvissa" puskurijärjestelmissä, jotka lisäävät merkittävästi näyteraitojen terävyyttä geelillä. Epäjatkuvassa geelijärjestelmässä on elektroforeesin alussa ionigradientti, joka saa kaikki proteiinit fokusoitumaan yhdeksi teräväksi raidaksi. Fokusoituminen tapahtuu geelin alkuosassa (kokoojageeli, engl. stacking gel), jossa on isompia huokosia, jolloin proteiinien vaellus ei hidastu huokosten takia. Puskurin negatiiviset ionit poistavat koottujen proteiinien ionigradientin ja proteiinit erottuvat loppumatkan normaalisti geelin erotteluosassa (engl. resolving gel).
Usein käytetään tris-glysiini tai "Laemmli"-puskurijärjestelmää, joka kokoaa ja erottelee proteiinit noin 8,3–9,0 pH:ssa. Kyseiset pH-arvot tukevat disulfidisidosten muodostumista proteiinin kysteiini-aminohappotähteiden välillä, erityisesti kun niiden konsentraatio on korkea, sillä kysteiinin pKa vaihtelee 8–9 välillä ja sillä pelkistin ei vaella geelillä proteiinien mukana. Viime aikoina on onnistuttu tuottamaan puskureita, joiden avulla proteiinit voidaan erotella kysteiinin pKa:n alle menevässä pH:ssa (esimerkiksi bis-tris, pH 6,5) ja sisällyttää erotteluun pelkistintä (esimerkiksi natriumbisulfaatti). Alhaisen pH:n puskurista on myös se hyöty, että akryyliamidigeeli säilyy näin kauemmin ja se voidaan varastoida pidemmiksi ajoiksi.
Lähteet
- Sørensen, B. ym: Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry, 2002, 304. vsk, s. 33–41. doi:10.1006/abio.2001.5604. (englanniksi)
- Schägger, H. & von Jagow, G.: Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry, 1987, 166. vsk, s. 368–379. doi:10.1016/0003-2697(87)90587-2. (englanniksi)
- Laemmli, U.: Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970, 227. vsk, s. 680–685. doi:10.1038/227680a0. (englanniksi)
Viitteet
- Deutscher, Murray: Guide to protein purification. Methods in Enzymology, 1990, 182. vsk, s. 1–818. PubMed:2314234. ISSN 0076-6879. Artikkelin verkkoversio. (englanniksi)