Rubisco
Rubisco eli ribuloosi-1,5-bisfosfaattikarboksylaasi[1] on tärkeä fotosynteesiin osallistuva entsyymi, joka katalysoi hiilidioksidin liittämistä ribuloosi-1,5-bisfosfaattiin ja syntyvän tuotteen hajoamista 3-fosfoglyseraatiksi. Entsyymiä tavataan yhteyttävistä kasveista, levistä ja fototrofisista bakteereista. Rubisco voi muodostaa noin 30 % kasvin lehtien proteiinimäärästä ja on todennäköisesti biosfäärin yleisin proteiini.[2]
| Rubisco | |
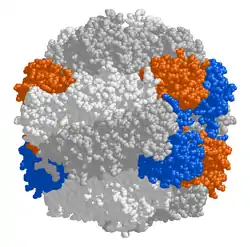 | |
| Malli rubiscon rakenteesta. Kahdeksan suurta alayksikköä on kuvassa valkoisena ja harmaana ja kahdeksan pientä alayksikköä sinisenä ja oranssina. | |
| Tunnisteet | |
| CAS-numero | 9027-23-0 |
| EC-numero | 4.1.1.39 |
| systemaattinen nimi | ribuloosi-1,5-bisfosfaattikarboksylaasi |
| Tietokannat | |
| KEGGt | KEGG |
Rakenne
Kasvien ja levien kloroplasteissa esiintyvä rubisco koostuu kahdeksasta suuresta alayksiköstä, jotka ovat kooltaan 51–58 kDa ja kahdeksasta pienestä alayksiköstä, jotka ovat kooltaan 12–18 kDa. Entsyymin aktiivinen keskus sijaitsee suurissa alayksiköissä. Pienet alayksiköt voivat parantaa suurten alayksikköjen katalyyttistä aktiivisuutta, mutta niiden tärkein tehtävä on tukea entsyymin rakennetta. Pienet alayksiköt eivät ole rubiscon toiminnalle välttämättömiä ja esimerkiksi eräillä purppurabakteereilla niitä ei ole lainkaan ja suuria alayksiköitäkin on vain kaksi.[2][3][4]
Mekanismi
Jotta rubisco toimisi katalyyttisesti aktiivisena entsyyminä, entsyymin säätelykohdassa sijaitsevan lysiiniaminohapon sivuketjun aminoryhmään täytyy liittyä hiilidioksidi, jolloin muodostuu karbamaattiryhmä, joka sitoutuu koentsyyminä toimivaan magnesiumioniin. Entsyymin substraatti ribuloosi-1,5-bisfosfaatti sitoutuu kuitenkin hyvin voimakkaasti tähän sivuketjuun ja estää rubiscon täydellisen toiminnan. Tämän vuoksi toinen entsyymi rubiscoaktivaasi irrottaa ribuloosi-1,5-bisfosfaatin ATP:tä kuluttavalla reaktiolla, ja näin sivuketjun karboksylaatio pääsee tapahtumaan ja entsyymin konformaatio muuttuu aktiiviseksi. Rubiscoaktivaasi on siis säätelyproteiini.[2][4][5][6]
Ribuloosi-1,5-bisfosfaatti sitoutuu magnesiumioniin ketoryhmänsä ja sen viereisessä hiilessä olevan hydroksyyliryhmän välityksellä. Magnesiumioni on sitoutunut lysiinin karbamaattiryhmän lisäksi myös entsyymin asparagiini- ja glutamiinihappojen sivuketjuihin. Lysiinin aminoryhmä poistaa substraatilta protonin, jolloin muodostuu enediolaattivälituote. Protoninsiirron seurauksena enediolaatti isomerisoituu toiseksi enediolaatiksi, johon rubisco liittää nukleofiilisellä additioreaktiolla hiilidioksidin, jolloin muodostuu 2-karboksi-3-keto-d-arabinitoli-1,5-bisfosfaattia. Tämä on hyvin pysymätön välituote, johon liittyy vesimolekyyli ja muodostuu hydroksi-β-ketohappo. Tämä hajoaa 3-fosfoglyseraatiksi aldolikondensaation käänteisreaktiolla.[2][7]
Rubisco voi katalysoida myös sivureaktiota, jossa ribuloosi-1,5-bisfosfaatista muodostunut enediolaatti reagoi hiilidioksidin sijasta hapen kanssa. Tällöin tuotteena syntyy molekyyli 3-fosfoglyseraattia ja molekyyli fosfoglykolaattia. Tämäkin reaktio vaatii, että lysiinin sivuketju on muodostanut karbamaatin. Reaktion arvellaan tapahtuvan hydroperoksidivälituotteen kautta, joka hajoaa, kun siihen liittyy vesimolekyyli. Muodostuneen fosfoglykolaatin kasvi käsittelee fotorespiraatioksi kutsutun metaboliareitin kautta. Fotorespiraatio on aktiivisimmillaan kuumina ja kuivina päivinä, jolloin kasvit sulkevat hiilidioksidinottoaukkonsa.[2][3][6]

(1) ribuloosi-1,5-bisfosfaatista, (3) 3-fosfoglyseraatti (4) 2-fosfoglykolaatti
Olosuhteet ja säätelytekijät
Rubisco tarvitsee toimiakseen koentsyymikseen magnesiumionin. Eräissä bakteereissa magnesiumin tilalla voi toimia myös mangaani tai rauta. Hiilidioksidin täytyy liittyä säätelykohtaan, jotta metalli-ionin sitoutuminen tapahtuisi. Myös valo aktivoi rubiscon toimintaa. Säteilyn vaikutusmekanismit ovat monimutkaiset, eikä niitä täysin ymmärretä. Säteily saa aikaan protonien siirtymisen tylakoidien kalvon läpi ulkopuolella olevaan tilaan ja magnesiumionien virran tylakoidiin. Tästä syntyy tylakoidin kalvon eri puolille protonigradientti ja pH tylakoidissa on noin 8, mikä on sopiva rubiscon toiminnalle ja hyvä erityisesti karbamaattiryhmän muodostumiselle.[2][6][8]
Rubiscoa inhiboivat monet orgaaniset sokerifosfaatit. Yksi tärkeimmistä inhibiittoreista on 2-karboksiarabinitoli-1-fosfaatti, joka muistuttaa rubiscon katalysoiman reaktion välituotetta 2-karboksi-3-keto-d-arabinitoli-1,5-bisfosfaattia. Se sitoutuu entsyymiin yli 1 000 kertaa voimakkaammin kuin ribuloosi-1,5-bisfosfaatti ja estää näin sen toiminnan. 2-karboksiarabinitoli-1-fosfaatti kertyy kasvien lehtiin yön aikana. Auringon paistaessa sen säteily aktivoi rubiscoaktivaasin, joka irrottaa inhibiittorin entsyymistä ja inhibiittori hajotetaan fosfataaseihin kuuluvalla spesifisellä entsyymillä.[3]
Lähteet
- Fotosynteettinen hiilihydraattisynteesi Solunetti. 2006. Viitattu 15.5.2012. (suomeksi)
- Jeremy M. Berg, John L. Tymoczko & Lubert Stryer: Biochemistry, 6th Edition, s. 567–570. W. H. Freeman and Company, 2006. ISBN 978-0-7167-8724-2. (englanniksi)
- Hans-Walter Heldt, Fiona Heldt: Plant biochemistry, s. 168–170, 173. Academic Press, 2005. ISBN 978-0-12-088391-2. Kirja Googlen teoshaussa. (englanniksi)
- Andrew Cobb, John Reade: Herbicides and Plant Physiology, s. 106. John Wiley and Sons, 2010. ISBN 978-1-4051-2935-0. Kirja Googlen teoshaussa. (englanniksi)
- Reginald Garrett,Charles M. Grisham: Biochemistry, s. 667. Cengage Learning, 2008. ISBN 978-0495109358. Kirja Googlen teoshaussa. (englanniksi)
- Maurice S. McDonald: Photobiology of higher plants, s. 75, 81–811. John Wiley and Sons, 2003. ISBN 978-0470855225. Kirja Googlen teoshaussa. (englanniksi)
- John McMurry, Tadhg P. Begley: The organic chemistry of biological pathways, s. 213. Roberts and Company Publishers, 2005. ISBN 978-0974707716. Kirja Googlen teoshaussa. (englanniksi)
- EC 4.1.1.39 - Ribulose-bisphosphate carboxylase Brenda. Viitattu 21.04.2011. (englanniksi)
Aiheesta muualla
- Näin fotosynteesi toimii Tiede.fi