Rauta-rikkiproteiini
Rauta-rikkiproteiini on proteiini, johon on kiinnittynyt rautaioni, joka ei ole sitoutunut hemiryhmään. Sen sijaan rauta on sitoutunut joko kysteiiniaminohappoon tai kysteiinin lisäksi rikkiatomeihin muodostaen klustereita, joissa rautaan voi olla sitoutuneina muitakin ligandeja. Monet rauta-rikkiproteiinit osallistuvat eliöiden aineenvaihdunnassa hapetus-pelkistysreaktioihin tai toimivat sensoreina tai proteiinin rakennetta tukevina yksiköinä.[1][2][3][4][5]
Rauta-rikkiproteiinien rakenne
Rauta-rikkiproteiineille tunnusomaista on, että proteiinit ovat kovalenttisesti sitoutuneet yksiköihin, joissa on yksi, kaksi, neljä tai kahdeksan rautaionia, rikkiatomeja ja mahdollisesti myös muita ligandeja. Näiden proteiinin molekyylimassa vaihtelee välillä 6–20 kDa. Rauta-rikkiproteiinit osallistuvat eliöiden aineenvaihdunnassa hapetus-pelkistysreaktioihin, koska rauta on stabiili sekä hapetusluvuilla +II että + III.[4]
Rubredoksiinit

Yksinkertaisimpia rauta-rikkiproteiineja ovat rubredoksiinit. Niiden rakenteessa rautaioni on sitoutunut joko neljään kysteiiniamonihappoon tai kahteen kysteiiniin ja kahteen histidiiniaminohappoon niin kutsuttujen Riesken proteiinien tapauksessa.[3][2][4][5]
2Fe-2S-klusterit

Kahdesta rautaionista, joita yhdistää kahden sikkiatomin muodostama rikkisilta on yksinkertaisin rauta-rikkiproteiinien sisältämistä klustereista. Ferredoksiineissa tämän klusterit rautaionit ovat koordinoituneet lisäksi proteiinissa neljään kysteiiniaminohappoon ja niin kustutuissa Riesken proteiineissa rautoihin koordinoituvat kaksi kysteiiniä ja kaksi histidiiniä. Tällainen proteiini on myös eliöiden hapetus-pelkistystasapainoa säätelevä SoxR-proteiini.[3][2][4][5]
4Fe-4S-klusterit
Neljästä rautaionista ja neljästä rikkiatomista koostuva rakenteeltaan kuutiomainen klusteri on yksi tyypillisimmistä rauta-riikiproteiineissa esiintyvistä klustereista. Nämä klusterit ovat lisäksi koordinoituneet kysteiiniaminohappoihin. Tätä klusteria esiintyy useissa hapetus-pelkistysreaktioita katalysoivissa entsyymeissä, kuten nitrogenaaseissa ja NADH-dehydrogenaasissa, radikaalireaktioita katalysoivissa entsyymeissä kuten biotiinisyntaasissa sekä eräissä muita kuin hapetus-pelkistysreaktioita katalysoivissa entsyymeissä kuten akonitaasissa ja amidofosforibosyylitransferaasissa. 4Fe-4S-klusteri esiintyy myös raudan imeytymistä ja kudoksissa siirtymistä säätelevissä proteiineissa.[1][3][2][4][5]
3Fe-4S-klusterit
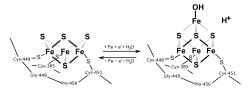
3Fe-4S-klusterit ovat harvinaisempia kuin 4Fe-4S-klusterit. Tällainen on esimerkiksi inaktiivisessa muodossa oleva akonitaasi, joka aktivoituu raudan lisäyksessä pelkistimen läsnä ollessa.[3][2][4][5]
Muita rauta-rikkiproteiineissa esiintyviä klustereita

Nitrogenaaseissa on 4Fe-4S-klusterien lisäksi 8 rauta-atomista ja 7 rikkiatomista koostuva klusteri, jonka keskusatomina on hiiliatomi ja lisäksi kolmeen rikkiatomiin on koordinoitunut myös molybdeeni-ioni. Rauta-atomit ovat lisäksi koosrdinoituneet kysteiiniaminohappoihin ja molybdeeni-ioni on koordinoitunut histidiiniin ja homositruunahappoon. Myös esimerkiksi hiilimonoksididehydrogenaasi sisältää useista rauta- ja rikkiatomeista koostuvan klusterin.[2]
Lähteet
- Jeremy M. Berg, John L. Tymoczko & Lubert Stryer: Biochemistry, 6th Edition, s. 484, 511, 681–682. W. H. Freeman and Company, 2006. ISBN 978-0-7167-8724-2. (englanniksi)
- G. N. Cohen: Microbial Biochemistry, s. 127–130. Springer, 2010. ISBN 978-90-481-9436-0. Kirja Googlen teoshaussa (viitattu 9.7.2015). (englanniksi)
- Ivano Bertini: Biological Inorganic Chemistry, s. 46–51. University Science Books, 2007. ISBN 978-1-891389-43-6. Kirja Googlen teoshaussa (viitattu 9.7.2015). (englanniksi)
- Guillermo Gonzalez-Moraga: Cluster Chemistry, s. 278–293. Springer, 2013. ISBN 978-3-540-56470-6. Kirja Googlen teoshaussa (viitattu 9.7.2015). (englanniksi)
- Anatoly Bezkorovainy: Biochemistry of Nonheme Iron, s. 343–389. Springer, 2012. ISBN 978-1-4684-3781-2. Kirja Googlen teoshaussa (viitattu 9.7.2015). (englanniksi)
