Ofloksasiini
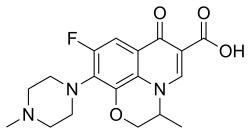
Ofloksasiini (C18H20N3O4F) on fluorokinoloneihin kuuluva orgaaninen yhdiste. Lääketieteessä sitä voidaan käyttää laajakirjoisena antibioottina muun muassa korvatulehduksen hoidossa.
 | |
Ofloksasiini | |
| Systemaattinen (IUPAC) nimi | |
| (RS)-9-fluori-2,3-dihydro-3-metyyli-10-(4-metyylipiperatsin-1-yyli)-7-okso-7H-pyrido[1,2,3-de]-1,4-bentsoksatsiini-6-karboksyylihappo | |
| Tunnisteet | |
| CAS-numero | |
| ATC-koodi | J01 |
| PubChem | |
| DrugBank | |
| Kemialliset tiedot | |
| Kaava | C18H20N3FO4 |
| Moolimassa | 361,37 |
| SMILES | Etsi tietokannasta: , |
| Fysikaaliset tiedot | |
| Sulamispiste | 250–257 °C (hajoaa)[1] |
| Farmakokineettiset tiedot | |
| Hyötyosuus | > 95 %[2] |
| Proteiinisitoutuminen | 32 %[3] |
| Metabolia | Hepaattinen |
| Puoliintumisaika | 7 h[2] |
| Ekskreetio | Renaalinen |
| Terapeuttiset näkökohdat | |
| Raskauskategoria |
? |
| Reseptiluokitus |
|
| Antotapa | Oraalinen, intravenoosi, topikaalinen |
Vaikutusmekanismi ja käyttökohteet
Ofloksasiini estää bakteerien DNA-gyraasientsyymin toimintaa, minkä vuoksi DNA:n kahdentuminen ei onnistu eivätkä bakteerit pääse kasvamaan ja lisääntymään. Yhdiste on laajakirjoinen antibiootti ja tehoaa useisiin sekä grampositiivisiin että gramnegatiivisiin bakteereihin. Yhdisteen S-enantiomeeri on raseemista seosta 8–128 kertaa tehokkaampi ja sitä myydäänkin myös puhtaana enantiomeerina nimellä levofloksasiini. Ofloksasiinia voidaan käyttää muun muassa salmonellan, korvatulehdusten, virtsatulehdusten ja tippurin hoitoon.[2][3][4][5][6][7]
Synteesi
Ofloksasiinin seitsenvaiheisen synteesin lähtöaine on 2,3,4-difluorinitrobentseeni.[5] Ensimmäisessä vaiheessa yhdiste reagoi emäksisissä olosuhteissa muodostaen 2,3-difluori-6-nitrofenolia, jonka hydroksyyliryhmä alkyloidaan emäksisissä olosuhteissa klooriasetonin avulla kaliumjodidin toimiessa katalyyttinä. Muodostuva yhdiste reagoi vedytettäessä Raney-nikkelin toimiessa katalyyttinä muodostaen bentsoksatsiinijohdannaisen. Tämä johdannainen reagoi seuraavassa vaiheessa dietyylietoksimetyleenimalonaatin kanssa ja tämä johdannainen reagoi edelleen polyfosforihapon läsnä ollessa syklisoituen kinoliinirakenteiseksi yhdisteeksi. Kaksi viimeistä ofloksasiinin synteesin vaihetta ovat esterin hydrolyysi ja aromaattisen renkaan fluoriatomin korvautuminen reaktiolla N-metyylipiperatsiinin kanssa.[8][9]
Lähteet
- Susan Budavari (päätoim.): Merck Index, s. 1163. 12th Edition. Merck & Co., 1996. ISBN 0911910-12-3. (englanniksi)
- Raimo K. Tuominen ja Pekka T. Männistö: 53. Nukleiinihappoihin vaikuttavat mikrobilääkkeet Farmakologia ja toksikologia. Medicina. Viitattu 14.6.2016.
- Ofloxacin DtugBank. Viitattu 14.6.2016. (englanniksi)
- John. F. Kadow, J. F. Barrett, D. Beaulieu, T. J. Dougherty, N.A. Meanwell, K. A. Ohemeng-Paratek & B. Ryan: Antibacterial Agents, Quinolones, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2002. Viitattu 14.6.2016
- Paul Actor, Alfred W. Chow, Frank J. Dutko & Mark A. McKinlay: Chemotherapeutics, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2000. Viitattu 14.6.2016
- Jukka Lumio: Fluorokinolonien käyttö. Duodecim, 1999, 115. vsk, nro 3, s. 304. Artikkelin verkkoversio. Viitattu 14.6.2016.
- Pentti Huovinen ja Raimo K. Tuominen: 54. Bakteeri-infektioiden rationaalinen hoito Farmakologia ja toksikologia. Medicina. Viitattu 14.6.2016.
- Ṛuben Vardanyan, Victor J. Hruby: Synthesis of essential drugs, s. 518–519. Elsevier, 2006. ISBN 978-0-444-52166-8. Kirja Googlen teoshaussa (viitattu 14.6.2016). (englanniksi)
- Douglas Scott Johnson, Jie Jack Li: The art of drug synthesis, s. 46–47. Wiley-Interscience, 2007. ISBN 978-0-471-75215-8. Kirja Googlen teoshaussa (viitattu 14.6.2016). (englanniksi)