Nitrogenaasi
Nitrogenaasi on entsyymikompleksi, joka katalysoi typpimolekyylien pelkistymistä ammoniakiksi. Nitrogenaasia esiintyy useissa bakteereissa ja arkeoneissa. Nitrogenaasin toiminta on keskeinen osa typensidontaa ja sitä kautta muun muassa kasvien kasvua. Nitrogenaasin rakenne ja toimintamekanismi on monimutkainen, eikä täysin tarkoin tunnettu. Nitrogenaasin EC-numero on EC 1.18.6.1.[1][2][3][4][5][6][7]

Rakenne ja toiminta

Nitrogenaasi on entsyymikompleksi, joka koostuu kahdesta toisiinsa yhteydessä olevasta proteiinista, jotka molemmat ovat rauta-rikkiproteiineja. Näistä reduktaasiosan tarkoitus on tuottaa typen pelkistykseen tarvittava määrä elektroneja. Nitrogenaasiosa vastaanottaa elektronit reduktaasiosalta ja katalysoi typen pelkistymistä ammoniakiksi.[1][2][3][4][5][6][7][8]
Reduktaasiosa
Nitrogenaasikompleksin reduktaasiosa on rakenteeltaan kahdesta samanlaisesta alayksiköstä koostuva dimeeri, jonka molekyylimassa on noin 28–35 kDa. Tässä proteiinissa on sitoutumiskohta ferredoksiinille tai vaihtoehtoisesti flavodoksiinille, sekä ATP-molekyyleille. Lisäksi entnsyymi vaatii magnesiumioneja, jotka koordinoituvat ATP-molekyyleihin ja nopeuttavat myös reaktiota. Tämän lisäksi nitrogenaasin reduktaasiosassa on tärkeänä 4 rauta-ionin ja 4 sulfidi-ionin ja 4 kysteiiniaminohapon muodostama klusteri. Reduktaasiosassa ferredoksiini tai flavodoksiini luovuttaa elektroneja raudan ja rikin muodostamalle klusterille itse hapettuen. Elektroninsiirtoon tarvittava energia saadaan hydrolysoimalla ATP-molekyylejä, jolloin niistä muodostuu ADP-molekyylejä. Yhden typpimolekyylimoolin pelkistämiseen ammoniakiksi vaaditaan kahdeksan moolia elektroneja. Jokaista elektronia kohden täytyy hydrolysoida kaksi ATP-molekyyliä, joten 8 elektronimoolin tuottamiseen entsyymi hydrolysoi 16 moolia ATP-molekyylejä. ATP:n hydrolyysin seurauksena nitrogenaasin konformaatio muuttuu ja reduktaasiosa siirtyy lähemmän nitrogenaasiosaa.[1][2][3][4][5][6][7][8]
Nitrogenaasiosa
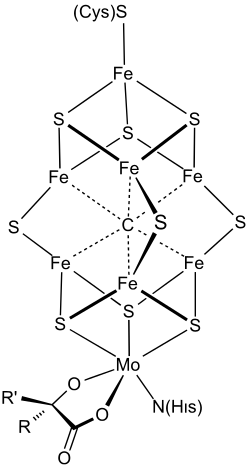
Nitrogenaasiosan toimintaa on tutkittu erityisesti Azotobacter-suvun bakteereilla. Nitrogenaasiosa on metalloproteiini ja rakenteeltaan tyypillisimmin tetrameeri. Tetrameeri koostuu kahdesta α-alayksiköstä, joka sisältään rauta- ja sulfidi-ionien muodostaman klusterin eli niin kutsutun P-klusterin. Lisäksi nitrogenaasissa on kaksi β-alayksikköä. Tämä alayksikkö sisältää hiiliatomista, rauta-ioneista ja sulfidi-ioneista koostuvan klusterin, jossa on lisäksi myös molybdeeni- tai vanadiini-ioni koordinoituneena homositruunahappoon ja histidiiniaminohappoon. Tätä klusteria kutsutaan FeMoco-klusteriksi. Bakteereilla klusterissa on molybdeeniatomi, mikäli solujen molybdeenipitoisuus on riittävä. Alhaisemmassa molybdeenipitoisuudessa klusterissa on vanadiini-ioni tai myös vanadiinipitoisuuden ollessa vähäinen on samassa paikassa rauta-ioni. Vanadiinia ja pelkästään rautaa sisältävän nitrogenaasin rakenne poikkeaa molybdeenia sisältävän entsyymin rakenteesta siten, että niissä on lisäksi myös kaksi γ-alayksikköä. Entsyymin toiminta on tehokkainta molybdeenin ollessa sitoutuneena.[2][3][4][5][6][7][8]
Elektroninsiirto reduktaasiosalta nitrogenaasiosalle ja edelleen typpimolekyylille tapahtuu vaiheittain. Lisäksi reaktiossa muodostuu vetyä. Vanadiinia sisältävät entsyymit toimivat alhaisemmassa lämpötilassa kuin moleybdeeniä sisältävät ja tuottavat ammoniakin lisäksi hieman myös hydratsiinia. Molybdeeniä ja vanadiinia sisältävät nitrogenaasit voivat typen lisäksi pelkistää myös etyyniä ja eteeniä etaaniksi, syanidi-ioneja metaaniksi ja ammoniakiksi, atsideja ammoniakiksi, dityppimonoksidia typeksi, asetaldehydiä etanoliksi ja tiosyanaatteja sulfideiksi, ammoniakiksi ja metaaniksi.[1][2][3][4][5][6][7][8]
Nitrogenaasin katalysoiman typen pelkistysreaktiota voidaan kuvata kokonaisreaktioyhtälöllä:
Lähteet
- EC 1.18.6.1 - nitrogenase Brenda. Viitattu 23.2.2017. (englanniksi)
- Jeremy M. Berg, John L. Tymoczko & Lubert Stryer: Biochemistry, 6th Edition, s. 680–683. W. H. Freeman and Company, 2006. ISBN 978-0-7167-8724-2. (englanniksi)
- Daniel L. Purich, R. Donald Allison: The Enzyme Reference, s. 614. Academic Press, 2003. ISBN 9780080550817. Kirja Googlen teoshaussa (viitattu 23.2.2017). (englanniksi)
- William E. Newton :Nitrogen Fixation, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2015. Viitattu 23.2.2017
- J. Elaine Barclay & G. Jeffery Leigh: Nitrogen Fixation, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2000. Viitattu 23.2.2017
- Thomas Scott, Mary Eagleson: Concise encyclopedia chemistry, s. 697. Walter de Gruyter, 1994. ISBN 978-3110114515. (englanniksi)
- Thomas Scott,Eric Ian Mercer: Concise encyclopedia biochemistry and molecular biology, s. 435–438. Walter de Gruyter, 1997. ISBN 978-3110145359. (englanniksi)
- Ivano Bertini: Biological Inorganic Chemistry, s. 469–484. University Science Books, 2007. ISBN 978-1-891389-43-6. Kirja Googlen teoshaussa (viitattu 23.2.2017). (englanniksi)