Nitreenit
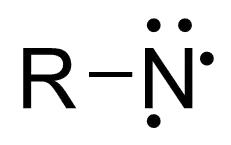
Nitreenit ovat orgaanisia yhdisteitä, joissa sähköisesti varautumattomalla typpiatomilla on kuusi elektronia uloimmalla kuorellaan, ja joista neljä on sitoutumatonta. Nitreenit ovat hyvin reaktiivisia ja muistuttavat rakenteeltaan ja monilta reaktioiltaan karbeeneja. Nitreenejä esiintyy useissa reaktioissa reaktiivisina välivaiheina.[1][2][3][4][5]
Rakenne ja ominaisuudet
Nitreeneissä neljästä sitoutumattomasta elektronista kaksi muodostaa vapaan elektroniparin ja kaksi elektronia on pariutumattomia. Kuten karbeeneilla näiden elektronien spinit voivat olla vastakkaiset, jolloin kyseessä on niin kutsuttu singlettitila, tai samansuuntaiset, jolloin kyseessä on triplettikarbeeni. Triplettitila on hieman singlettitilaa stabiilimpi. Nitreenit ovat hyvin elektrofiilisia ja reaktiivisia. Tavanomaisissa olosuhteissa niitä ei pyritä eristämään, mutta eräitä alkyylinitreenejä on onnistuttu eristämään 4 K (–269 °C) ja aryylinitreenejä on kyetty eristämään 77 K (–196 °C) lämpötilassa. Asyylinitreenit ovat hieman tavanomaisia nitreenejä stabiilimpia[1][2][3][4][5]
Reaktiivisuus
Singlettinitreenien ja triplettinitreenien reaktiot poikkeavat toisistaan siten, että siglettinitreenit reagoivat radikaalien tavoin, kun taas triplettinitreenit reagoivat yhtäaikaisreaktioilla. Karbeenien tavoin nitreenit reagoivat nukleofiilien kanssa additioreaktiolla tai insertioreaktiolla. Nitreeni kykenee insertoitumaan muun muassa C-H- tai C-C-sidoksiin muodostaen amiineja ja esimerkiksi reaktiossa alkeenien tai fullereenien kanssa muodostuu atsiridiineja. Erittäin tyypillisiä ovat migraatioreaktiot imiineiksi ja toisiintumiset isosyanaateiksi. Nitreenien toisiintumisia isosyanaateiksi tapahtuu muun muassa Curtius-, Hofmann- ja Lossen-toisiintumisissa. Aryylinitreenit toisiintuvat helposti muodostaen seitsenatomisen didehydroatsepiinirenkaan. Muita nitreenien reaktioita ovat abstraktioreaktiot ja dimerisoitumiset. Mikäli aromaattisen nitreeniin nähden orto-asemassa on substituentti reagoi nitreeni tämän substituentin kanssa usein molekyylinsisäisellä reaktiolla.[3][4][5][6]
Nitreenien valmistus
Tyypillisin tapa valmistaa nitreenejä on orgaanisten atsidien hajottaminen kuumentamalla eli termolyysi tai valokemiallisesti eli fotolyysin avulla. Termolyysissä muodostuu tyypillisesti triplettinitreeni ja fotolyysissä singlettinitreeni. Singlettinitreeni voi muuttua energiatilaltaan alhaisemmaksi triplettikarbeeniksi. Muita nitreenien valmistustapoja on esimerkiksi sulfonyyliatsidien termolyysi ja reaktio voimakkaiden emäksien kanssa.[4][5][6]
Lähteet
- Nitrenes IUPAC GoldBook. IUPAC. Viitattu 5.8.2015. (englanniksi)
- Leila Kotama ja Antti Kivinen: Suomalaisten Kemistien Seuran sanastotoimikunnan julkaisuja nro 5: Fysikaalisen orgaanisen kemian sanasto, s. 94. Suomen Kemian Seura, 1983. ISBN 951-9223-20-7. (englanniksi)
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organic Chemistry, s. 1022. Oxford University Press, 2012. ISBN 978-0-19-927029-3. (englanniksi)
- Michael B. Smith & Jerry March: March's Advanced Organic Chemistry, s. 293–296. John Wiley & Sons, 2007. ISBN 978-0-471-72091-1. (englanniksi)
- Francis A. Carey & Richard J. Sundberg: Advanced Organic Chemistry B: Reactions and synthesis, s. 944–947. Springer, 2007. ISBN 978-0-387-68350-8. (englanniksi)
- William M. Horspool, Francesco Lenci: CRC handbook of organic photochemistry and photobiology. CRC Press, 2003. ISBN 9780849313486. Kirja Googlen teoshaussa (viitattu 5.8.2015). (englanniksi)