Neuraminidaasi
Neuraminidaasit eli sialidaasit ovat glykosidihydrolaasientsyymejä, jotka halkaisevat neuramiinihappojen glykosidisidoksia. Neuraminidaasientsyymejä on paljon ja niitä esiintyy monissa organismeissa. Yleisesti tunnetuin neuraminidaasi on virusten pinnan neuraminidaasi, joka on oseltamiviiri ja tsanamiviiri nimisten influenssainfektiolääkkeiden vaikutuskohde. Influenssavirusten pinnalta löytyviä neuraminidaaseja käytetään usein antigeenideterminantteina eli epitooppeina. Jotkut influenssavirusten neuraminidaasit antavat virukselle enemmän virulenssia kuin toiset neuraminidaasit. Nisäkässolujen neuraminidaaseilla on monia tehtäviä. Ainakin neljä nisäkäsneuraminidaasihomologia on kuvattu ihmisen genomissa.[2]
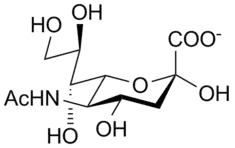
Virusten neuraminidaasit katalysoivat vastavalmistuneiden virionien ja isäntäsolun reseptorien terminaalisten sialihappotähteiden hydrolyysiä.[3] Virusten neuraminidaasien aktiviteetteihin kuuluvat viruspartikkeleiden kulkeutumisen avustaminen hengitysteiden liman läpi ja virionin tuottamien jälkeläisten poistumisen avustaminen infektoituneesta solusta.[4][5]
Reaktio
On olemassa kaksi neuraminidaasipääluokkaa, jotka halkaisevat joko ekso- tai endopolysiaalihappoja:
Alatyypit
Swiss-Prot listasi 18. lokakuuta vuonna 2006 jo 137 neuraminidaasityyppiä eri lajeista. Influenssaneuraminidaaseista tunnetaan yhdeksän alatyyppiä; kaikkia yhdeksää alatyyppiä löydetään yleisesti lintujen influenssaviruksista, mutta nisäkkäiden influenssaviruksista löydetään vain tiettyjä alatyyppejä. Ihmisistä ja sioista löydetään yleisesti vain N1 ja N2 alatyyppejä.[8] Influenssavirusten eri alatyyppien neuraminidaaseille on ominaista serologisen ristireaktiivisuuden puuttuminen ja noin 50 prosentin aminohapposekvenssihomologia.[9] Virusten, alkueläinten, sienten, lintujen ja nisäkkäiden lisäksi neuraminidaaseja on myös bakteereissa, joissa ne ovat tärkeitä patogeenisyyden kannalta.[10]
Rakenne
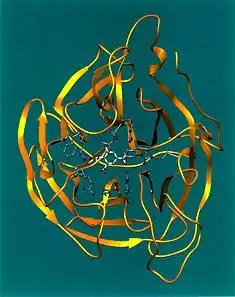
Influenssaneuraminidaasit ovat homotetrameerisia glykoproteiineja ja ne esiintyvät sienen muotoisina ohutvartisina projektioina influenssaviruksen pinnalla. Neuraminidaasin kokonaismolekyylipaino on noin 240 kDa, josta sienimäisen pääosan osuus on noin 200 kDa. Ohut varsiosa ankkuroi neuraminidaasin viruksen kalvoon. Molekyylin pää on täysin vastuussa neuraminidaasin entsymaattisesta aktiivisuudesta.[11]
Katso myös
Lähteet
- Bossart-Whitaker P, Carson M, Babu YS, Smith CD, Laver WG, Air GM: Three-dimensional structure of influenza A N9 neuraminidase and its complex with the inhibitor 2-deoxy 2,3-dehydro-N-acetyl neuraminic acid. J Mol Biol, 1993, 232. vsk, nro 4, s. 1069–83. RCSB PDB: Structure Summary. (englanniksi)
- Monti E, Bassi MT, Bresciani R, Civini S, Croci GL, Papini N, Riboni M, Zanchetti G, Ballabio A, Preti A, Tettamanti G, Venerando B, Borsani G: Molecular cloning and characterization of NEU4, the fourth member of the human sialidase gene family. Genomics, 2004, 83. vsk, nro 3, s. 445–53. Molecular cloning and characterization of NEU4, the fourth member of the human sialidase gene family. (englanniksi)
- von Itzstein M: The war against influenza: discovery and development of sialidase inhibitors. Nature Reviews. Drug Discovery, 2007, 6. vsk, nro 12, s. 967–74. The war against influenza: discovery and development of sialidase inhibitors. (englanniksi)
- Palase P, Tobita K, Ueda M, Compans RW: Characterization of temperature sensitive influenza virus mutants defective in neuraminidase. Virology, 1974, 61. vsk, nro 2, s. 397–410. Characterization of temperature sensitive influenza virus mutants defective in neuraminidase. (englanniksi)
- Liu C, Eichelberger MC, Compans RW, Air GM: Influenza type A virus neuraminidase does not play a role in viral entry, replication, assembly, or budding. Journal of Virology, 1995, 69. vsk, nro 2, s. 1099–106. Influenza type A virus neuraminidase does not play a role in viral entry, replication, assembly, or budding. (englanniksi) (Arkistoitu – Internet Archive)
- Schauer R: Chemistry, metabolism, and biological functions of sialic acids. Adv Carbohydr Chem Biochem, 1982, 40. vsk, s. 131–234.
- Cabezas JA: Some questions and suggestions on the type references of the official nomenclature (IUB) for sialidase(s) and endosialidase. Biochem J, 1991, 278. vsk, nro Pt 1, s. 311–2. Some questions and suggestions on the type references of the official nomenclature (IUB) for sialidase(s) and endosialidase. (englanniksi)
- Sylte MJ, Suarez DL: Influenza neuraminidase as a vaccine antigen. Curr Top Microbiol Immunology, 2009, 333. vsk, s. 227–41. Influenza neuraminidase as a vaccine antigen. (englanniksi)
- Baker AT, Varghese JN, Laver WG, Air GM, Colman PM: Three-dimensional structure of neuraminidase of subtype N9 from an avian influenza virus. Proteins, 1987, 2. vsk, nro 2, s. 111–7.
- Hsiao YS, Parker D, Ratner AJ, Prince A, Tong L: Crystal structures of respiratory pathogen neuraminidases. Biochem Biophys Res Commun, 2009, 13. vsk, nro 380, s. 467–71. Crystal structures of respiratory pathogen neuraminidases. (englanniksi)
- Burmeister WP, Ruigrok RW, Cusack S: The 2.2 A resolution crystal structure of influenza B neuraminidase and its complex with sialic acid. EMBO J, 1992, 11. vsk, nro 1, s. 49–56. The 2.2 A resolution crystal structure of influenza B neuraminidase and its complex with sialic acid. (englanniksi)