NADH-dehydrogenaasi
NADH-dehydrogenaasi eli kompleksi I tai NADH-ubikinonioksidoreduktaasi on entsyymi, joka osallistuu eliöissä soluhengityksen osana olevaan elektroninsiirtoketjuun. Entsyymi katalysoi reaktiota, jossa NADH-molekyyli hapetetaan NAD+-molekyyliksi ja hapettumisessa vapautuvat elektronit siirretään hapetus- ja pelkistysreaktioiden sarjan kautta ubikinonille, joka pelkistyy ubikinoliksi. NADH-dehydrogenaasia esiintyy niin aitotumaisissa kuin esitumaisissakin eliöissä. NADH-dehydrogenaasin EC-numero on EC 1.6.5.3.[1][2]

Rakenne ja toiminta
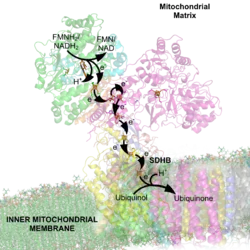
NADH-hydrogenaasi on rakenteeltaan ja toiminnaltaan monimutkainen entsyymi. Se on molekyylimassaltaan hyvin suuri, tyypillisesti yli 900 kDa. Sen rakenne koostuu noin 46 aminohappoketjusta ja lisäksi se sisältään raudan ja rikin muodostamia klustereita eli on rauta-rikkiproteiini. Muodoltaan NADH-muistuttaa L-kirjainta tai vanhaa saapasmallista kenkää. NADH-reduktaasia esiintyy erityisesti mitokondrioissa, joissa se on mitokondrion sisäkalvon proteiini.[1][2][3][4][5]
NADH-reduktaasi katalysoi ensimmäisessä vaiheessa NADH:n hapettumista NAD+-molekyyliksi. Hapettimena toimii flaviinimononukleotidi (FMN), jonka isoalloksatsiinirengas pelkistyy reaktiossa. Näin muodostunut FMNH2-molekyyli luovuttaa elektroneja rauta-rikkiklustereille, joissa ne siirtyvät edelleen ja FMNH2 hapettuu muodostaen jälleen flaviinimononukleotidia. Rauta-rikkiklusterit luovuttavat elektronit mitokondrion sisäkalvon ubikinonille, joka pelkistyy ubikinoliksi. Elektroninsiirron lisäksi NADH-dehydrogenaasi toimii protonipumppuna, joka siirtää 4 H+-ionia mitokondrion matriisista mitokondrion sisäkalvon läpi. Protoninsiirron tarkkaa mekanismia ei tunneta.[2][3][4][5]
Yksi voimakkaimmin NADH-dehydrogenaasia inhiboivista yhdisteistä on rotenoni, jonka teho rikkaruoho- ja tuholaismyrkkynä perustuu tähän. Lisäksi entsyymiä inhiboi muun muassa pierisidiini A, MPTP, kapsaisiini ja eräät lääkeaineet. NADH-dehydrogenaasin toimintahäiriöt ovat myös osallisia useisiin sairauksiin muun muassa Parkinsonin tautiin, laktiseen asiduriaan sekä etenevään lihasten heikkouteen.[1][4]
Lähteet
- EC 1.6.5.3 - NADH:ubiquinone reductase (H+-translocating) Brenda. Viitattu 21.2.2017. (englanniksi)
- Jeremy M. Berg, John L. Tymoczko & Lubert Stryer: Biochemistry, 6th Edition, s. 510–512. W. H. Freeman and Company, 2006. ISBN 978-0-7167-8724-2. (englanniksi)
- Pamela C. Champe,Richard A. Harvey,Denise R. Ferrier: Biochemistry, s. 75. Lippincott Williams & Wilkins, 2008. ISBN 978-0-7817-6960-0. Kirja Googlen teoshaussa (viitattu 21.2.2017). (englanniksi)
- William J. Lennarz,M. Daniel Lane: Encyclopedia of Biological Chemistry, s. 83–90. Elsevier, 2013. ISBN 9780123786302. Kirja Googlen teoshaussa (viitattu 21.2.2017). (englanniksi)
- Oksidatiivinen fosforylaatio Solunetti. Viitattu 21.2.2017.