Kryoelektronimikroskopia
Kryoelektronimikroskopia, elektroni kryomikroskopia tai kryo-EM (engl. cryo-EM) on läpivalaisuelektronimikroskopian (TEM) muoto, jossa näytteen rakennetta tutkitaan läpäisemällä se 200–300 kV elektronisuihkun avulla hyvin kylmissä (kryogeenisissä) olosuhteissa, jotka on tavallisesti saavutettu nestemäisen typen avulla. Elektronisuihku on ikään kuin "valo" ja näytteen tätä "valoa" puoliläpäisevät molekyylit muodostavat suihkulla valaistaessa "varjon" mittalaitteelle, josta näytteen molekyylirakenne voidaan päätellä[1] esimerkiksi sen luonnollisessa eli natiivissa muodossa.[2] Kryo-EM:n käyttö rakennebiologiassa on saavuttanut suosiota 2010-luvulla.[3]
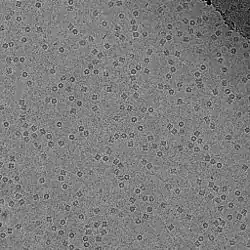
Kryo-EM sopii muun muassa virusten,[3] ribosomien, mitokondrioiden, ionikanavien ja jopa pienten 170 kDa entsyymikompleksien rakennetutkimukseen noin 4.5 Å erotustarkkuudella eli resoluutiolla.[1] Kryo-EM laitteistojen resoluutio on kuitenkin parantunut vuosien myötä ja 2015 mennessä kryo-EM:n avulla on saavutettu jopa 2.2 Å resoluution kuva erään bakteerin entsyymistä (PDB-koodi: 5A1A).[4]

Kryo-EM:n eräs versio on kryoelektronitomografia (engl. CET, ECT, cryo-ET), jossa tutkitun näytteen eri kulmiin jäätyneistä 2D-kuvista tehdään 3D-ennallistus/kollaasi, eli tomogrammi. Lisäksi näytelevyä käännellään tietokoneohjatusti kuvauksen aikana useamman kuvakulman saamiseksi. Pelkässä kryo-EM:ssä tehdään saman kuvakulman molekyyleistä pelkkä 2D-kuva ilman näytelevyn kääntelyä.[2]
Makromolekyylien rakennetutkimusmenetelmien vertailu
Kryo-EM:ää voidaan myös kutsua natiiviksi elektronimikroskopiaksi, sillä menetelmän hyödyllisiin ominaisuuksiin kuuluu muun muassa se, että tutkittavat aineet ovat tutkimuksen aikana niille luontaisessa eli natiivissa muodossa muun muassa täysin hydratoituneina. Niitä ei tarvitse kiteyttää. Tämän vastakohtana on esimerkiksi röntgenkristallografia, jossa näyte täytyy kiteyttää usein sille ei-luontaisissa oloissa, jolloin kuvatun näytteen rakenne voi poiketa merkittävästi sen biologisissa kudoksissa esiintyvästä rakenteesta. Lisäksi kiteytys voi viedä hyvin runsaasti aikaa. Kryo-EM:n avulla voidaan myös tutkia vaikeasti kiteytettäviä näytteitä, kuten löyhästi sitoutuneiden proteiinikompleksien rakenteita niiden luontaisessa muodossa[2] ja asymmetrisiä kalvoproteiineja,[1] joista jälkimmäisten kiteyttäminen röntgenkristallografiaa varten voi olla mahdotonta.[3]
Röntgenkristallografialla selvitettyjen makromolekyylien resoluutio on tyypillisesti välillä 1.5–2.5 Å ja parhaimmillaan alle 1 Å. Synkrotronitutkimukseen vaaditut kidekoot ovat pienimmillään nanometriluokkaa.[5]
Kryo-EM:ssä tutkittavan aineen massan alarajana on nykyisillä (2018) laitteistoilla ja tekniikoilla on jo noin 64 kDa.[6] Ihanteellisessa tilanteessa teoreettinen massan alaraja on 38 kDa.[1] Tällä hetkellä kryo-EM on lähinnä röntgenkristallografian heikkouksia täydentävä tekniikka.[6] Kryo-EM soveltuu parhaiten suurten biomolekyylikompleksien ja aggregaattien tutkimukseen, röntgenkristallografia puolestaan suuren resoluution tutkimukseen.[5]
| Menetelmä | Edut | Haittapuolet | Sopivat näytteet | Resoluutio |
|---|---|---|---|---|
| Röntgenkristallografia |
|
|
Suuri. | |
| NMR-spektroskopia |
|
|
|
Suuri. |
| Kryo-EM |
|
|
|
Verrattain pieni (alle 3.5 Å). |
Biologiset näytteet
Ohuen kalvon menetelmä
Ohuen kalvon menetelmässä nestemäinen näyte levitetään elektronimikroskoopin näytelevyverkkoon alle 500 nm paksuiseksi kalvoksi, sillä yli 1 000 nm kalvoa elektronisuihku ei kykene läpäisemään merkittävästi.[2] Tyypillisesti kalvo jäädytetään nopeasti kastamalla näyte nestemäisellä typellä jäähdytettyyn nestemäiseen etanoliin. Tällä menetelmällä jäähtyminen on kyllin nopeaa estämään tutkittavan aineen rakenteen rikkovien suurten vesikiteiden muodostuminen. Epätasaisen kiteytymisen sijaan tapahtuu tasainen vitrifikaatio. Toisin kuin valomikroskopian valo, elektronit siroavat voimakkaasti ilman kaasuseoksesta: jäädyttämällä näyte voidaan se sijoittaa elektronimikroskoopin vaatimaan vakuumiin, eli lähellä tyhjiötä olevaan tilaan, jossa elektronisuihku voi edetä vapaasti. Jäädytettyä näytettä on myös mahdollista säilyttää useita päiviä ilman merkittävää sublimoitumista.[8]
Vaikka kylmä lämpötila suojaa näytettä hajoamiselta, liian voimakas tai pitkäaikainen elektronisuihkutus voi silti vaurioittaa helposti herkimpiä näytteitä, joten niitä täytyy usein säteilyttää elektronisuihkulla mahdollisimman vähän. Pienten säteilyannosten käyttö kuitenkin vähentää menetelmällä saatujen kuvien tarkkuutta, joten jos on mahdollista, niin tietyssä kulmassa olevista näytemolekyyleistä tehdään tietokoneohjelman avulla automaattisesti päällekkäinen kuvakollaasi. Tämä parantaa kuvatarkkuutta. Tomografisessa menetelmässä näytelevyä tämän lisäksi käännellään 3D-kuvan saamiseksi.[9]
Muut näytteet
Kryo-EM:ää voidaan käyttää myös kuvaamaan näytteitä, jotka ovat liian helposti haihtuvia huoneenlämmössä tapahtuvalle tavalliselle elektronimikroskooppiselle kuvantamiselle. Kryo-EM:ää voidaan käyttää esimerkiksi neste-kiinteä rajapintojen tutkimiseen[10] tai vaikka rikin rakennetutkimukseen, sillä rikki sublimoituu helposti elektronimikroskoopin vakuumissa huoneenlämmössä.[11]
Lähteet
- W Kühlbrandt: Cryo-EM enters a new era. eLife, 13.8.2014, nro 3. PubMed:25122623. doi:10.7554/eLife.03678. ISSN 2050-084X. Artikkelin verkkoversio.
- V Lučić, A Rigort, W Baumeister: Cryo-electron tomography: The challenge of doing structural biology in situ. The Journal of Cell Biology, 5.8.2013, 202. vsk, nro 3, s. 407–419. PubMed:23918936. doi:10.1083/jcb.201304193. ISSN 0021-9525. Artikkelin verkkoversio.
- E Callaway: The revolution will not be crystallized: a new method sweeps through structural biology. Nature, 10.9.2015, 525. vsk, nro 7568, s. 172–174. PubMed:26354465. doi:10.1038/525172a. ISSN 1476-4687. Artikkelin verkkoversio.
- A Bartesaghi, A Merk, S Banerjee, D Matthies, X Wu, JLS Milne: 2.2 Å resolution cryo-EM structure of β-galactosidase in complex with a cell-permeant inhibitor. Science, 5.6.2015, 348. vsk, nro 6239, s. 1147–1151. PubMed:25953817. doi:10.1126/science.aab1576. ISSN 1095-9203. Artikkelin verkkoversio.
- G Zanotti: Cryo-EM and X-Ray Crystallography: Complementary or Alternative Techniques? NanoWorld Journal, 12.8.2016, 2. vsk, nro 2. doi:10.17756/nwj.2016-025. Artikkelin verkkoversio.
- SC Shoemaker, N Ando: X-rays in the Cryo-Electron Microscopy Era: Structural Biology's Dynamic Future. Biochemistry, 23.1.2018, 57. vsk, nro 3, s. 277–285. PubMed:29227642. doi:10.1021/acs.biochem.7b01031. ISSN 1520-4995. Artikkelin verkkoversio.
- Comparison of Crystallography, NMR and EM creative-biostructure.com. Arkistoitu 17.11.2017. Viitattu 13.11.2017.
- EH Egelman: The Current Revolution in Cryo-EM. Biophysical Journal, 8.3.2016, 110. vsk, nro 5, s. 1008–1012. PubMed:26958874. doi:10.1016/j.bpj.2016.02.001. ISSN 0006-3495. Artikkelin verkkoversio.
- V Lučić, A Rigort, W Baumeister: Cryo-electron tomography: The challenge of doing structural biology in situ. The Journal of Cell Biology, 5.8.2013, 202. vsk, nro 3, s. 407–419. PubMed:23918936. doi:10.1083/jcb.201304193. ISSN 0021-9525. Artikkelin verkkoversio.
- MJ Zachman, E Asenath-Smith, LA Estroff, LF Kourkoutis: Site-Specific Preparation of Intact Solid-Liquid Interfaces by Label-Free In Situ Localization and Cryo-Focused Ion Beam Lift-Out. Microscopy and Microanalysis, joulukuu 2016, 22. vsk, nro 6, s. 1338–1349. PubMed:27869059. doi:10.1017/S1431927616011892. ISSN 1435-8115. Artikkelin verkkoversio.
- BDA Levin, MJ Zachman, JG Werner, R Sahore, KX Nguyen, Y Han: Characterization of Sulfur and Nanostructured Sulfur Battery Cathodes in Electron Microscopy Without Sublimation Artifacts. Microscopy and Microanalysis, helmikuu 2017, 23. vsk, nro 1, s. 155–162. PubMed:28228169. doi:10.1017/S1431927617000058. ISSN 1435-8115. Artikkelin verkkoversio.