B12-vitamiini
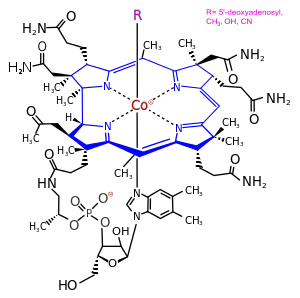
B12-vitamiinit ovat vitamiineja ja ryhmä substituoidun korriinirenkaan ja 5,6-dimetyylibentsimidatsolin ribonukleotidin muodostamia aineita, joissa renkaan keskelle on kuudesta kohtaa oktaedrisesti sitoutunut koboltti-ioni. Ioniin sitoutunut kuudes ryhmä eli ligandi vaihtelee ja kaikkia tämän rakenteen omaavia aineita sanotaan kobalamiineiksi, vaikka ne eivät toimisi vitamiineina. Eri kobalamiineja on luonnossa yli 20, joista osa ei kuitenkaan toimi eläimillä B12-vitamiinina tai ne imeytyvät huonosti. Syanokobalamiini on yleisin lisäravintoaineisiin lisätty B12-vitamiini, mutta sitä ei juuri ole luonnossa.[6]
 | |
 | |
B12-vitamiini | |
| Systemaattinen (IUPAC) nimi | |
| ? | |
| Tunnisteet | |
| CAS-numero | |
| ATC-koodi | B03 |
| PubChem | |
| DrugBank | |
| Kemialliset tiedot | |
| Kaava | C63H88CoN14O14P |
| Moolimassa | 1 355,365 g/mol |
| Fysikaaliset tiedot | |
| Tiheys | 0,4–0,8[1] g/cm³ |
| Sulamispiste | 300 °C [1] |
| Liukoisuus veteen | Liukoinen (noin 12,5 g/l)[1] |
| Farmakokineettiset tiedot | |
| Hyötyosuus | Nieltynä 50 % < 0,5 μg, 20 % 1 μg, ~1 % 500 μg;[2] lihaspistoksena 100 % 3 µg, 93 % 40 µg, 15 % 1 000 µg[3] |
| Proteiinisitoutuminen | 70–80 %[4] |
| Metabolia | ? |
| Puoliintumisaika | 350–400 pv[4] |
| Ekskreetio | Sappi ja vähemmässä määrin virtsa[4] |
| Terapeuttiset näkökohdat | |
| Raskauskategoria |
C(US)[5] |
| Reseptiluokitus | |
| Antotapa | Nieltynä; nenäsuihkeena; pistoksena lihakseen, ihon alle tai verenkiertoon[5] |
Oheisen tietolaatikon tiedot ovat syanokobalamiinille.
B12-vitamiinia esiintyy lähinnä eläinkunnan tuotteissa,[4] ja sitä voi kertyä ylimäärin joidenkin eliöiden kudoksiin. Ihmisten B12-varastot kestävät noin 3–5 vuotta.[7]
B12:tä tuottavat vain tietyt bakteerit ja arkeonit aerobisesti tai anaerobisesti omiin tarpeisiinsa.[8] Useimmat aitotumaiset, joihin myös ihmiset ja kaikki muut eläimet kuuluvat, eivät tuota B12:tä, mutta tarvitsevat sitä elääkseen. Poikkeuksena ovat tietyt levät, jotka muuntavat syanobakteerien tuottamaa pseudokobalamiinia paitsi itsellään myös eläimilläkin vitamiinitoimintoiseksi B12:ksi. Kasvit ja sienet eivät tarvitse tai tuota B12:tä.[9] Nautojen ja monien muiden märehtijöiden pötsimikrobit tuottavat kylliksi B12:tä eläimen tarpeeseen, mutta mikrobisynteesi riippuu eläimen koboltin ravintosaannista.[4]
Suositukset ja saanti
Yhdysvaltain elintarvike- ja lääkeviraston mukaan B12-vitamiinin saannin pitäisi olla 2,4 mikrogrammaa vuorokaudessa[10].
Suomen valtion ravitsemusneuvottelukunnan mukaan yli 10-vuotiaiden päiväsaannin pitäisi olla 2 mikrogrammaa vuorokaudessa[11].
| Ikäryhmä
(miehet ja naiset) | |
|---|---|
| < 6 kk | a |
| 6–11 kk | 0,5 |
| 12–23 kk | 0,6 |
| 2–5 v | 0,8 |
| 6–9 v | 1,3 |
| > 10 v | 2 |
| Raskaana olevat | 2 |
| Imettävät | 2,6 |
a: Äidinmaito tai äidinmaidonkorvike tyydyttää alle 6 kk ikäisten ravinnetarpeet.
B12-vitamiinin imeytyminen elimistöön heikkenee ihmisen ikääntyessä etenkin 60-ikävuoden jälkeen[12].
Vuonna 2017 tarkasteltiin FinRavinto-tutkimukseen osallistuneiden 18–74-vuotiaiden suomalaisten ravitsemusta. Tuolloin miehet saivat "B12-vitamiinia" keskimäärin 6,6 mikrogrammaa vuorokaudessa (µg/vrk) ja 0,7 µg per ruoasta ravintoenergiana saatu megajoule (µg/MJ). Naisilla nämä arvot olivat 4,9 µg/vrk ja 0,7 µg/MJ. Miehistä 100% sai B12-vitamiinia saantisuositusten mukaisesti ja 0% alle keskimääräisen tarpeen (eli alle 1,4 µg/vrk). Naisilla nämä osuudet olivat vastaavasti 100% ja 0% (eli alle 1,4 µg/vrk). "Keskimääräinen tarve" tyydyttää ravinnetarpeen puolella väestöstä, mutta sitä hieman alhaisempi saanti ei silti välttämättä johda oireilevaan puutostilaan.[13]
Liikasaanti
Suomen valtion ravitsemusneuvottelukunta tai EFSA ei ole esittänyt enimmäissuosituksia B12-vitamiinin saannille.[11][14] B12-vitamiinia voidaan pitää turvallisena aineena, sillä isoistakin annoksista saadut haittavaikutukset ovat hyvin harvinaisia.[15] Ihmiset sietävät hyvin esimerkiksi nieltyjä 2 mg/vrk (2 000 µg/vrk) annoksia tai lihaspistoksena otettuja 1 mg/vrk annoksia syanokobalamiinia.[16]
Syanokobalamiinin LD50 on hiirille yli 5 g/kg suun kautta ja 2 g/kg pistoksena vereen.[17]
Puutos
Syyt
Yleisin syy B12-puutokseen ovat imeytymishäiriöt.[4][15] Mahalaukun sisäpinnan parietaalisolut tuottavat B12:n imeytymisessä tärkeää proteiinia, jota kutsutaan nimellä sisäinen tekijä. Yleisin syy puutokseen on siten atrofinen gastriitti eli surkastuttava mahalaukkutulehdus, jossa parietaalisoluja kuolee vaikkapa mahasyövän, mahan helikobakteeritartunnan tai autoimmuunisyiden takia.[4] Sisäisen tekijän tuoton vähenemistä autoimmuunisyistä parietaalisolutuhon kautta kutsutaan nimellä pernisiöösi anemia. Mahalaukkutulehduksen eri muotoja ilmenee eritoten vanhuksilla.[15] Lisäksi luonnon B12 on ravintoproteiineissa kiinni, joista se vapautuu maha- eli suolahapon ja eritoten hapon aktivoiman pepsiini-entsyymin avulla. Parietaalisolut tuottavat suolahappoa. Siten niiden tuho vaikeuttaa imeytymistä myös tältä osin,[4] mutta mahan suolahapottomuutta (aklorhydriaa) tai vähäistä suolahappoisuutta (hypoklorhydriaa) aiheuttavat muutkin tekijät altistaen siten B12-puutokselle – eräs tekijä on kilpirauhasen vajaatoiminta.[18]
Mahalaukun kirurginen osittaispoisto voi johtaa puutokseen. Oireet alkavat noin 4 vuoden jälkeen poistosta. Koko mahan poisto johtaa aina puutokseen. Leikkaus voi johtaa myös raudanpuuteanemiaan, joka voi häiritä suurentuneita eli makrosyyttisiä punasoluja aiheuttavan B12-puutoksen toteamista, sillä raudanpuuteanemiassa solut ovat poikkeavan pieniä eli mikrosyyttisiä.[15]
Eräs syy B12-puutokseen on sen alisaanti ruoasta. Kasviperäisissä ruuissa ei itsessään ole B12:tä, joten usean vuoden jatkunut vegaaniruokavalio suurella todennäköisyydellä johtaa puutokseen ilman B12-lisäravinteiden säännöllistä käyttöä. Puutosta voi ilmetä myös rintaruokinnassa olevalla vauvalla mikäli imettäjällä on lievä tai vakava B12-puutos.[4]
Haiman tulehdus tai muu haimavika voi alentaa sen trypsiinin eritystä. Trypsiini pilkkoo muun muassa B12-muotoja sitovia tyypin 1 transkobalamiineja (TC1) ohutsuolessa. Keho tuottaa TC1:iä osana B12:n imeytymismekanismia, mutta hajotuksessa vapautuvat B12:t eivät kiinnity ohutsuolessa kyllin runsain määrin sisäisiin tekijöihin, jos TC1:iä alkaa kertyä suolistoon.[4]
Imeytymistä voi estää myös ohutsuolitulehdus, ripuli tai loiset, kuten heisimadot. Loiset kilpailevat suoliston kanssa B12:n saannista.[4]
Tietyt lääkkeet voivat aiheuttaa B12-puutosta. Pitkäaikaisen käyttötapansa takia näistä todennäköisimmin puutokselle altistavia ovat mahan happamuutta alentavat aineet kuten PPI-lääkkeet ja diabeteslääkkeinä käytetyt biguanidit[15] kuten metformiini ja fenformiini.[4] Metformiinin kaltaisten aineiden puutosta aiheuttava mekanismi on tuntematon.[19] Toistuva altistus ilokaasulle (N2O) voi johtaa puutokseen. Syy on se, että N2O hapettaa metyylikobalamiinin koboltin hapetusasteelta Co(I) tilaan Co(III) metioniinisyntaasin katalysoiman reaktion aikana estäen reaktion.[15]
Oireet
Puutoksessa ilmenee ensisijaisesti peruuttamattomia hermosto-oireita, joita ovat esimerkiksi ataksia, raajojen asentoaistin menetys, tunnottomuus ja muu kehoalueissa symmetrisesti etenevä parestesia. Symmetristä näön menetystä voi ilmetä myös, mutta harvoin.[20] Hermo-oireet johtuvat myeliinin tuhosta eli demyelinaatiosta. Tuho alkaa usein ääreishermostosta eli käsistä ja jaloista, ja etenee hajanaisesti lopulta selkäytimeen. Pitkittyneessä puutoksessa oireita voi ilmetä myös keskushermostossa. Näitä ovat muun muassa unohtelu, masennus, ärtymys, psykoosi, dementia[4] ja lopulta tappava tahdosta riippumattoman hermoston toiminnan pettäminen.[15] Demyelinaatio liittyy B12:tä vaativan metyylimalonyyli-CoA-mutaasin vajaatoimintaan, joka on osa myeliinin tuottoa.[20]
Puutos aiheuttaa myös megaloblastista anemiaa. Tämä ei aina silti ilmene ennen hermosto-oireita. Vakavaan anemiaan liittyviä oireita ovat esimerkiksi rintakivut, nopea hengästyminen, pystyasentoon liittyvä verenpaineen lasku eli ortostaattinen hypotensio, sekavuus ja väsymys. Myös sydämen vajaatoimintaan liittyvää nilkkojen turvotusta ja muita vastaavia oireita voi ilmetä. Lievää ummetusta tai ripulia ja virtsan tai ulosteen pidätysvaikeuksia voi ilmetä.[20]
Verenkuva ja virtsa
B12:n ravinnollisessa puutoksessa ja joistain muistakin syistä johtuvissa B12-puutoksissa ilmenee kohonnut homokysteiinin veripitoisuus eli homokysteinemia. Myös formiminoglutamiinihappojen (FIGLU) ja metyylimalonihappojen (MMA) virtsapitoisuudet ovat koholla. Jos MMA-pitoisuus on normaali, mutta muut arvot ovat koholla, voi puutosoireiden syy olla folaattipuutos. B12- ja folaattipuutoksessa folaattipitoisuudet laskevat. Molemmissa ilmenee megaloblastista anemiaa. MMA-pitoisuuksista voidaan siis todeta B12-puutos.[4] Terveillä seerumin MMA-pitoisuudet ovat 0–0,4 µmol/l (0–47 µg/l).[21] Kohonneiden metyylimalonihappoarvojen lisäksi todetut kohonneet malonihappoarvot voivat tosin myös viitata usein huomiotta jätettyyn [22] metaboliseen sairauteen, yhdistettyyn maloni- ja metyylimalonihappovirtsaisuuteen (CMAMMA).[23]
| Puutos | Veren homokysteiini |
Veren folaatti |
Megaloblastinen anemia? |
Virtsan FIGLU |
Virtsan MMA |
|---|---|---|---|---|---|
| B12 | koholla | laskenut | kyllä | koholla | koholla |
| Folaatti | koholla | laskenut | kyllä | koholla | normaali |
Syy B12- tai folaattipuutoksen homokysteinemialle on se, että molemmat vitamiinit ovat osa metioniinisyntaasia, joka metyloi homokysteiiniä metioniiniksi. Toisen tai molempien vitamiinien puutos estää syntaasin toimintaa.[15]
Metioniinisyntaasin metylaatio tapahtuu 5-metyylitetrahydrofoolihapon (5-MTHF) avulla, josta muodostuu metioniinisyntaasin reaktiossa tetrahydrofoolihappoa (THF). B12-puutoksessa 5-MTHF:ää ei kulu ja sitä kertyy kehoon. Samalla metyloimattoman THF:n saatavuus vähenee. Tästä johtuu veren folaattipitoisuuden lasku B12-puutoksen aikana.[4] Folaattien iso ja toistuva saanti esimerkiksi suuren folaattipitoisuuden lisäravinteista kiertää tämän folaattien loppumisesta aiheutuvan ongelman ja lievittää folaattipuutoksen oireita. Iso folaattisaanti voi siis estää B12-puutoksen lääketieteellistä toteamista, jolloin B12-puutos pitkittyy ja voi johtaa helpommin hermovaurioihin.[15]
B12-puutos johtaa edellä kuvatulla tavalla THF-puutokseen. THF:ää tarvitaan syntaasin lisäksi entsyymeissä, jotka ovat osa DNA:n tymidiinin ja puriinien tuottoa, kuten tymidylaattisyntaasissa (EC-numero 2.1.1.45). Siten DNA-synteesi estyy ja myös solunjakautuminen. Tästä johtuu B12- tai folaattipuutoksen megaloblastinen anemia eli punasolujen suurentuminen niiden jäädessä solujakautumisen puoliväliin punasolukypsymisen eli erytropoieesin aikana.[15]

B12-puutos aiheuttaa THF-puutosta edellä kuvatulla tavalla. FIGLU on histidiinin hajotuksen välituote. Siksi FIGLU-pitoisuudet kasvavat molemmissa puutoksissa eritoten syötäessä iso histiniidiannos.[4] Ilman THF:ää FIGLU:lta ei voi poistua formiminoryhmä (–CH=NH) glutamaattiformimidoyylitransferaasilla (EC-numero 2.1.2.5).[24] Tästä johtuu FIGLU:n veripitoisuuden kasvu B12- tai folaattipuutoksessa.[4]
Virtsan MMA-pitoisuus kasvaa B12-puutoksessa, muttei folaattipuutoksessa. Pitoisuudet kasvavat eritoten syötäessä propionihappoa tai muita parittoman hiiliketjun rasvahappoja. Syy pitoisuuskasvuun on näitä rasvoja käsittelevän metyylimalonyyli-CoA-mutaasin vajaatoiminta, joka vaatii toimiakseen adenosyylikobalamiinia, joka on eräs B12-muoto.[15]
Ruokapitoisuudet
Eläinperäiset ruoat eli lihat, maitotuotteet ja munat sisältävät B12-vitamiinia. Erityisen paljon sitä on muun muassa eläinten maksoissa ja munuaisissa, kaloissa, naudanlihassa, kypsytetyissä juustoissa sekä joissain simpukoissa.[4] Kasveissa, sienissä tai muissa ei-eläinperäisissä ruuissa ei lähtökohtaisesti ole B12:tä, mutta bakteerit, joille ruoat ovat altistuneet, voivat tuottaa sitä.[15][9] Kasviperäiset ruoat eivät silti ole luotettava B12-lähde, joten vegaanien kannattaa siksi syödä B12-lisäravinteita tai ruokia, joihin sitä on lisätty.[11]
Vitamiinitoimintoista B12:tä on useita muotoja ja ruuissa se on pääosin metyyli-, adenosyyli- ja hydroksokobalamiinina.[7] Ruokien B12 kestää verrattain hyvin ruoanlaitossa käytettyjä lämpötiloja.[15] Arviolta 25–65 % ruokien B12:stä imeytyy riippuen ruoasta. Saannin ylittäessä noin 2 mg/vrk, B12:n hyötyosuus alenee suuresti kehon imeytymisjärjestelmien kyllästyessä vitamiinista.[4]
| Lehmänmaitotuotteet | Lihat | ||
|---|---|---|---|
| Briejuusto | 1,65 | Ankka, paahdettu | 0,4 |
| Camembertjuusto | 1,30 | Kalkkuna, iholla, paahdettu | 0,35 |
| Cheddarjuusto | 0,83 | Kana, iholla, paahdettu | 0,32 |
| Edamjuusto | 1,54 | Kirjolohi (viljelemätön), paistettu | 6,3 |
| Maito, rasvaton | 0,38 | Makrilli, paistettu, kuivattu | 19 |
| Raejuusto, 1 % rasvaa | 0,63 | Nauta, maksa, käristetty[26] | 111,34 |
| Sinihomejuusto | 1,22 | Nauta, kylki, ¼ rasvaa, pariloitu | 2,87 |
| Voi | 0,13 | Nauta, munuaiset, pariloitu[26] | 31,00 |
| Kerma, 31,3 % rasvaa[26] | 0,20 | Osteri, tölkitetty | 19,13 |
| Herajauhe, makea[26] | 2,00 | Sika, jalka, vähärasvainen, paahdettu | 0,72 |
| Jugurtti, 3.3 % rasvaa[26] | 0,37 | Silli, säilyke | 4,27 |
| Muut | Simpukat (useita lajeja), leivitetty, paistettu | 40,27 | |
| Kananmuna, keitetty | 1,11 | Turska, paistettu | 1,05 |
| Ihmisenmaito | 0,045 | ||
| Olut | 0,02 | ||
| Leivinhiiva, tuore (puristehiiva) | 0 | ||
| Vegaaninen | |||
| Tempeh | 0,7–8,0[27] tai 0,08[28] | ||
| Keltavahvero (itiöemä) | 1,09–2,65[27] | ||
| Suolilevät (kuivatut) | 63,6[27] | ||
| Ruoat ovat raakoja eli valmistamattomia ellei toisin mainita. Pitoisuudet ovat keskimääräisiä. Lähteissä ei ole määritetty minä B12-muotona B12-pitoisuuksien massat (µg) ovat. | |||
Jotkin syanobakteerit voivat tuottaa B12:n tapaisia aineita, jotka eivät kuitenkaan toimi vitamiinina.[9] Esimerkki tällaisesta on 7-adeninyylisyanokobalamidi[27] eli pseudokobalamiini, jota syanobakteerit käyttävät omanlaisenaan "B12-vitamiinina" solutoimintoihinsa. Tietyt levät kuten Pavlova lutheri kuitenkin kasvavat vain saadessaan pseudokobalamiinin lisäksi 5,6-dimetyylibentsimidatsolia, joka on osa eläinten vaatimia B12-vitamiinimuotoja. Jotkin levät (levät kuuluvat aitotumaisiin) siis pystyvät tuottamaan eläimilläkin toimivaa B12-vitamiinia omiin elintoimintoihinsa ympäristönsä pseudokobalamiinista.[9]
Kemia
Kobalamiinirakenne

Kobalamiinit ovat koordinaatiokompleksien ryhmä. Niissä on kaikissa korriinirengas. Osassa renkaan hiilistä on kiinni asetamidien, propaaniamidien ja metaanien radikaaleja. Renkaan keskellä on sen pyrrolien typpiin 4:stä kohtaa koordinoitunut koboltti-ioni (Co). Propaaniamidiin on amidisidoksella kiinnittynyt (S)-1-amino-2-propanoli, joka muodostaa joustavan varren molekyyliin. Aminopropanolin OH-ryhmässä on fosfoesterisidoksella kiinni D-riboosi-5-fosfaatti. Tässä on kiinni α-glykosidisidoksella 5,6-dimetyylibentsimidatsoli N1-typestään. Tämä dimetyylibentsimidatsolin ribonukleotidirakenne on kiertynyt aminopropanolivarren ansiosta korriinin alle. Dimetyylibentsimidatsolin N3-typpi on 5. kobolttiin koordinoitunut ligandi.[6]
 |
 |
 |
2-propanoli |
5-fosfaatti |
bentsimidatsoli |
Kobalamiinien kobolttiin on koordinoitunut vielä 6. ligandi. Koordinaatio kobolttiin on kokonaisuudessaan siten likimain oktaedristä. Jos ligandi on syanoryhmä (−CN), on kobalamiinin nimi syanokobalamiini. Mahdollisia ligandeja on monia ja yhdiste voi olla vaikkapa 5-deoksiadenosyyli-, akva- (ligandi on −OH2), bromo- (−Br), kloro- (−Cl), metyyli- (−CH3), nitro- (−NO2) tai hydroksokobalamiini (−OH).[29] Luonnon kobalamiineja tunnetaan ainakin 20, joista osa ei kuitenkaan toimi eläimillä vitamiinina tai ne imeytyvät huonosti.[6]
Syanokobalamiini

Syanokobalamiinia ei ole juuri luonnossa, mutta se on eräs vakaimpia B12-muotoja, jonka takia sitä käytetään usein B12-ravintolisissä.[30]
Se muodostaa tummanpunaisia, hajuttomia ja mauttomia kiteitä, jotka ovat neulas- tai särmiömäisiä. Kuivana se on hygroskooppinen ja voi kerätä jopa 12 % kosteuspitoisuuden itseensä. Se on liukoinen veteen ja etanoliin, liukenematon asetoniin, dietyylieetteriin ja kloroformiin.[1] Sen vesiliuokset ovat optisesti aktiivisia.[31]
Se kestää ilman happea ja muutaman tunnin ajan kuumennusta 100 °C:seen asti. Sen vesiliuoksia pH-arvossa 4–7 voidaan autoklavoida jonkin aikaa 120 °C:ssa ilman että sitä hajoaa merkittävästi. Vesiliuoksissa se voi muuntua hydroksokobalamiiniksi. Syanokobalamiini hajoaa hitaasti, mutta peruuttamattomasti UV-säteilyssä tai voimakkaassa valossa. Happamassa nukleotidi hydrolysoituu irti – lisää hydrolyyttistä hajoamista tapahtuu tätäkin happamammassa. Emäksisissä oloissa amidisidokset hydrolysoituvat ja muodostuu vitamiineina toimimattomia B12-karboksyylihappoja.[30]
Muut kobalamiinit

Keskenään erilaisten kobalamiinien rakenne on muuten sama, mutta 6. ligandi on eri. Kobalamiineja nimetään niiden 6. ligandin mukaan.[15] Syanokobalamiini ja sen monet johdannaiset eivät fluoresoi.[32] Muita yleisten kobalamiinien perusominaisuuksia on alla.
| Nimet | Ra | g/mol[32] | Hajoamis- lämpötila (°C)[31] |
Vesi- liukoisuus (g/l)[31] |
Absorptio- maksimi (nm)[32] |
Molaarinen absorptiokerroin (mol–1 cm–1 dm3)[32] |
Väri[32] |
|---|---|---|---|---|---|---|---|
| Syanokobalamiini | −CN | 1 355,4 | 278 | 8 700 | Tumman-
punainen | ||
| 261 | 27 600 | ||||||
| 551 | 8 700 | ||||||
| Hydroksokobalamiini | −OH | 1 346,4 | 200 | 107,0 | 279 | 19 000 | Tumman-
punainen |
| 325 | 11 400 | ||||||
| 516 | 8 900 | ||||||
| 537 | 9 500 | ||||||
| Akvakobalamiini | −OH2 | 1 347,0 | 274 | 20 600 | Tumman-
punainen | ||
| 317 | 6 100 | ||||||
| 351 | 26 500 | ||||||
| 499 | 8 100 | ||||||
| Nitrokobalamiini | −NO2 | 1 374,6 | 352 | 21 000 | Tumman-
punainen | ||
| 357 | 19 100 | ||||||
| 528 | 8 400 | ||||||
| 535 | 8 700 | ||||||
| Metyylikobalamiini | −CH3 | 1 344,4 | 210 | 13,4 | 266 | 19 900 | Tumman-
punainen |
| 342 | 14 400 | ||||||
| 522 | 9 400 | ||||||
| Adenosyylikobalamiini
Kobamamidi |
−dAdob | 1 579,6 | 150 | 15,0 | 288 | 18 100 | Kelta-
oranssi |
| 340 | 12 300 | ||||||
| 375 | 10 900 | ||||||
| 522 | 800 | ||||||
| a: R on kobolttiin (Co) sitoutunut atomiryhmä
b: 5'-deoksiadenosyyli | |||||||
Valmistus
Kobalamiineja tuotetaan teollisesti mikrobien avulla. Nämä tuottavat seoksen, jossa on muun muassa adenosyyli-, metyyli- ja hydroksokobalamiinia. Kobalamiinit puhdistetaan erilleen ja muutetaan kemiallisesti ravintolisissä usein käytetyksi syanokobalamiiniksi esimerkiksi kaliumsyanidin avulla suuressa paineessa tai lämpötilassa.[33]
Kemiallista synteesiä ei käytetä teollisuudessa. Synteesissä välivaiheita on noin 70.[33]
Toiminta eliöissä
B12-muodot ovat eliöissä koentsyymien roolissa eli ne ovat välttämätön osa tiettyjen entsyymien suorittamia reaktioita. Ihmisissä ja muissa eläimissä B12-riippuvaisia entsyymeitä on vain kaksi:[4]
- metyylimalonyyli-CoA-mutaasi. Tämä sitoo 2 adenosyylikobalamiinia ja toimii mitokondrioiden matriisissa muuntaen L-metyylimalonyylikoentsyymi-A:ta sukkinyylikoentsyymi-A:ksi. Reaktio on osa β-oksidaatiota, jossa hajotetaan hiiliketjuiltaan parittomia rasvahappoja. Näiden oksidaation lopussa muodostuu propionihappoa, jonka käsittelyyn entsyymi osallistuu. Entsyymi on osa myös tiettyjen aminohappojen hajotusta.[4]
- metioniinisyntaasi. Tämä metyloi homokysteiiniä metioniiniksi solulimassa metyylikobalamiinin ja 5-MTHF:n (metyloitu folaatti) avulla.[4]
Mikrobeissa B12:n rooli on laajempi. Adenosyylikobalamiinia vaativia mikrobientsyymeitä ovat muun muassa metyyliaspartaattimutaasi (EC-numero 5.4.99.1), 2-metyleeniglutaraattimutaasi (5.4.99.4), D-lysiini-5,6-aminomutaasi (5.4.3.3), β-lysiini-5,6-aminomutaasi (5.4.3.4), D-ornitiini-4,5-aminomutaasi (5.4.3.5), leusiini-2,3-aminomutaasi (5.4.3.7), propaanidiolidehydrataasi (4.2.1.28), glyserolidehydrataasi (4.2.1.30), etanolamiiniammonialyaasi (4.3.1.7) ja ribonukleotidireduktaasi (1.17.4.1).[4]
B12:n koboltin hapetusaste muuttuu siitä riippuvissa entsyymeissä, mutta lepotilassa aste on Co(III). Kaikissa eliöiden B12-entsyymeissä B12:n rooli voidaan jakaa kolmeen reaktiotyyppiin:[15]
- mutaasireaktiot, joissa B12:n koboltin hapetusaste on reaktion aikana aina Co(II). Mutaasit vaihtavat toistensa viereisten hiiliatomien sitomien atomien tai atomiryhmien paikkoja keskenään. Esimerkki on metyylimalonyyli-CoA-mutaasi. Tietyissä entsyymeissä mutaasireaktiota saattaa seurata välitön veden tai ammoniakin eliminaatioreaktio (irtoaminen) entsyymillä reagoivasta molekyylistä, kuten vaikka vastaavasti glyserolidehydrataasin ja etanolamiiniammonialyaasin kohdalla.[15]
- ribonukleotidireduktaasin reaktio, jossa hapetusaste on reaktion aikana aina Co(II).[15]
- metyylin siirtoreaktiot, joissa hapetusaste on reaktion aikana aina Co(I). Esimerkki on metioniinisyntaasi.[15]
Muu biokemia
Imeytyminen
- Pääartikkeli: B12-vitamiinin sitoutuminen transkobalamiiniin
Ruoan B12 on pääosin koentsyyminä kiinni ravintoproteiineissa. Vitamiini vapautuu niistä kuumentamalla, mahahapon avulla hydrolyyttisesti ja eritoten entsymaattisesti mahassa erittyvän pepsiinin avulla.[4] Ihmisillä eri B12-muodot sitoutuvat vapaina nopeasti haptokorriineihin eli tyypin 1 transkobalamiineihin (TC1, geeni TCN1), joita on mahanesteessä, ohutsuolessa ja muuallakin kehossa.[4][15]
Haima erittää trypsiiniä ohutsuoleen. Se hajottaa TC1:t niiden päätyessä mahalaukusta ohutsuoleen.[15] B12 vapautuu ja sitoutuu parietaalisolujen erittämiin sisäisiin tekijöihin (IF, eng. intrinsic factor).[34] IF:iä erittyy vasteena mahalaukkuun tulleelle ruoalle, histamiinille, gastriinille tai synteettiselle pentagastriinille. B12:n sitoutuminen on suotuisampaa IF:iin kuin TC1:iin ohutsuolen mahalaukkua emäksisemmissä oloissa.[4] IF:ien geneettinen puutos johtaa B12-puutokseen, jota ei silti kutsuta oireiltaan ja mekanismiltaan samantapaiseksi pernisiöösiksi anemiaksi (katso kohta Syyt). Isoin ero anemiaan on se, että geenipuutoksen oireet ilmenevät 1–3-vuotiaana ja anemiassa usein yli 60-vuotiaana. Lisäksi geenipuutoksessa vatsahapon eritys on normaalia, vatsakudos ei tuhoudu ja kehossa ei ole vasta-aineita kehon omille parietaalisoluille.[15]
Ohutsuolisoluihin IF-B12-kompeksit päätyvät endosytoosilla reseptorivälitteisesti. Reseptoriin osallistuvat kubiliini (geeni CUBN), megaliini (LRP2), amnionless (AMN) ja RAP (eng. receptor-associated protein). Soluissa B12:t irtoavat IF:stä ja liittyvät tyypin 2 transkobalamiineihin (TC2, geeni TCN2). Tämä TC2-B12-kompleksi siirtyy vereen.[35] Reseptorin jonkin proteiinin toimimattomuus estää imeytymistä ja johtaa Imerslund-Gräsbeckin tautiin.[15]
Verestä TC2-B12-kompleksi siirtyy sitä vaativiin soluihin TC2-reseptorin (geeni CD320) ja megaliinin avulla.[34] Soluissa kompleksi päätyy lysosomeihin, joissa TC2 irtoaa. B12 vapautuu kob(III)alamiinina solulimaan. Tästä osa muuntuu solulimassa metyylikobalamiiniksi metioniinisyntaasilla ja osa mitokondrioissa adenosyylikobalamiiniksi metyylimalonyyli-CoA-mutaasilla.[35]
Kuljetus
Ihmisillä veriplasman B12-muodoista 70–80 % on sitoutunut TC1- ja 20–30 % TC2-proteiineihin. Plasmassa ei ole sisäisiä tekijöitä (IF:iä).[15] Terveillä plasmassa B12:tä on keskimäärin noin 290 pikomoolia per litra (pmol/l).[4] Veriseerumin normaalit viitearvot ovat 138–652 pmol/l ja tätä alemmat pitoisuudet kertovat todennäköisesti B12-puutoksesta.[36]
Varastoituminen
Ihmiskeho varastoi ja kierrättää tehokkaasti B12:tä, jota terveillä ihmisillä on kehossa usein 2–5 mg. Noin 60 % tästä on maksassa ja noin 30 % lihaksissa. Kokoon suhteutettuna vitamiinin suurimmat pitoisuudet ovat aivolisäkkeessä. Muita suuren pitoisuuden elimiä ovat sydän, munuaiset, perna ja aivot.[4] Aikuisilla kehon varannot riittävät usein noin 3–5 vuotta vitamiinin saannin loppumisesta.[7]
Hajotus ja erittyminen
B12-vitamiinit eivät tiettävästi muunnu eri kobalamiinimuotojensa lisäksi eläinten kehoissa minkään muunlaisiksi aineenvaihduntatuotteiksi ennen pois erittymistään. Eläimillä B12:n kokonaisvarannoista noin 0,1–0,2 % (eli ihmisillä 2–5 µg) erittyy sappinesteessä ja virtsassa poispäin kehosta. Eritys tapahtuu pääosin sapen kautta ohutsuoleen. Sapessa erittynyt määrä ihmisillä on 0,5–5 μg/vrk, josta kuitenkin normaalisti noin 65–75 % imeytyy jälleen päätyen verenkierrossa muualle kehoon imeytymättömän osion poistuessa ulosteen mukana.[4]
Historia ja nimet
Ensimmäisenä pernisiöösin anemian lääketieteellisenä kuvauksena pidetään usein Thomas Addisonin 1849 esittämiä kuvauksia anemiaan liittyvistä oireista. Hän kuvaili muun muassa raajoista muualle kehoon etenevää kalpeutta, lihasheikkoutta, nilkkojen turvotusta ja tapauskohtaisesti lopulta kuolemaan johtavia oireita.[37][38] 1872 Michael Anton Biermer (elänyt 1827–1892) nimesi tilan pernisiöösiksi anemiaksi, jossa pernisiöösi tarkoittaa kuolettavaa.[39][40] Sana tulee latinan tuhoa tarkoittavasta sanasta, pernicies.[41] Anemian tutkimukset muiden alla kuvattujen merkittävien löydösten kautta johtivat lopulta myös B12:n löytymiseen.[38] Esimerkiksi 1877 William Osler ja William Gardner kuvailivat anemiaan liittyviä hermosto-oireita.[42] 1878 Georges Hayem kuvaili veren punasolujen olleen suurentuneita anemiassa.[43] 1880 Paul Ehrlich tunnisti anemiaa potevilla olevan suurentuneita punasoluja eli megaloblasteja luuytimissä.[44] 1887 Ludwig Lichtheim tunnisti selkäydinhermon vaurioiden eli myelopatian liittyvän anemian hermosto-oireisiin.[45]
Läpimurto pernisiöösin anemian hoidossa tapahtui 1926, kun George Minot ja William Murphy havaitsivat suurten (120–240 g) ja päivittäisten naudan maksa-annosten parantavan pernisiöösin anemian oireet. Eläinten maksoissa on paljon B12-vitamiinia, joka tunnistettiin anemiaan vaikuttavaksi tekijäksi kuitenkin vasta myöhemmin.[46][47] Koska pernisiöösissä anemiassa on B12:n imeytymiseen vaadittavan sisäisen tekijän puutos ja naudan maksassa on verrattain vähän B12:tä, on myöhemmin esitetty että Minotin ja Murphyn potilailla havaitsema terveyden koheneminen johtui osin myös potilailla ehkä olleesta folaatti- ja rautapuutoksesta. Näiden puutos aiheuttaa myös anemian eri muotoja ja niitä on paljon eläinten maksoissa.[47]
1929 William Bosworth Castle (1897–1990)[48] osoitti mahanesteessä olevan jokin tuntematon kehon erittämä eli "sisäinen tekijä", joka sitoutui maksassa olevaan tuntemattomaan "ulkoiseen tekijään" (B12-vitamiiniin) vatsahaposta tai pepsiinistä riippumattomasti. Kokeissaan Castle syötti terveille ihmisille proteiineja lihan muodossa. Noin 45 minuutin ruoansulatuksen jälkeen terveet oksensivat ulos mahanestettä, joka annettiin pernisiöösiä anemiaa poteville nenäletkulla. Anemiaa potevien anemian paranemiseen johtava vaste veressä oli lähes samanlainen kuin Minotin ja Murphyn maksan ruokintakokeissaan havaitsema.[49][47]
Useat tutkijat pyrkivät selvittämään Minotin ja Murphyn havaintoa. Vasta 1948 kaksi tutkijaryhmää eristivät lähes yhtaikaa ja toisistaan riippumattomasti puhdasta B12-vitamiinia syanokobalamiinin muodossa. Nimi syanokobalamiini kuitenkin keksittiin vasta myöhemmin. Ensimmäinen ryhmä olivat Karl Folkers (1906–1997) ja kollegat Merckille työskennellessään. He myös nimesivät aineen B12-vitamiiniksi.[50][47] He kuitenkin julkaisivat tutkimuksensa vasta noin viiden kuukauden kuluttua löydöksestään. Toiseksi tullut tutkijaryhmä olivat Ernest Lester Smith (1904–1992) ja kollegat, jotka eristivät aineen Glaxon laboratorioissa (nykyinen Glaxo Smith Kline).[51][52]
Syanokobalamiinin eristämisen jälkeen löydettiin muitakin B12-muotoja kuten adenosyylikobalamiini. Siksi 1950 Folkers ja kollegat antoivat B12-vitamiineille yleisnimen kobalamiini, johon liitettiin etuliitteitä kuten syano ja adenosyyli tarkentamaan vitamiinien kemiallisia koostumuksia.[53][54]
1956 Dorothy Hodgkin ja kollegat selvittivät syanokobalamiinin kolmiulotteisen rakenteen röntgenkristallografialla.[55][47]
B12:n täyden synteesin kehittäminen kesti noin 11 vuotta ja vaati lähemmäs 100:n tutkijan yhteistyön.[15] 1972 useat tutkijaryhmät yhteistyössä onnistuivat syntetisoimaan B12:n syanokobalamiinina. Tämän projektin keskeisiin tutkijoihin kuuluivat muun muassa Robert Burns Woodward ja Albert Eschenmoser (1925–).[56][57]
 M. A. Biermer
M. A. Biermer W. Osler
W. Osler G. Hayem
G. Hayem L. Lichtheim
L. Lichtheim K. Folkers
K. Folkers
Lähteet
- GF Combs et al: The vitamins: fundamental aspects in nutrition and health. 3. painos. Elsevier Academic Press, 2008. ISBN 9780121834937.
- R Obeid et al: Vitamin B12: advances and insights. CRC press, 2017. ISBN 9781498706995.
Viitteet
- Safety and efficacy of vitamin B12 (in the form of cyanocobalamin) produced by Ensifer spp. as a feed additive for all animal species based on a dossier submitted by VITAC EEIG. EFSA Journal, 2018, 16. vsk, nro 7. doi:10.2903/j.efsa.2018.5336. Artikkelin verkkoversio. [vanhentunut linkki]
- C Paul, DM Brady: Comparative bioavailability and utilization of particular forms of B12 supplements with potential to mitigate B12-related genetic polymorphisms. Integrative Medicine: A Clinician's Journal, 2017, 16. vsk, nro 1, s. 42–49. PubMed:28223907. ISSN 1546-993X. Artikkelin verkkoversio.
- Obeid, s. 17
- Combs, s. 381–397
- Vitamin B12 Drugs.com. Viitattu 5.5.2019.
- B Caballero et al: Encyclopedia of food sciences and nutrition, s. 1419–1426. 2. painos. Academic Press, 2003. ISBN 9780122270550. Teoksen verkkoversio.
- Combs, s. 474, 477
- H Fang, J Kang, D Zhang: Microbial production of vitamin B12: a review and future perspectives. Microbial Cell Factories, 2017, 4. vsk, nro 16. PubMed:28137297. doi:10.1186/s12934-017-0631-y. ISSN 1475-2859. Artikkelin verkkoversio.
- A Grossman: Nutrient acquisition: the generation of bioactive vitamin B12 by microalgae. Current biology, 2016, 26. vsk, nro 8, s. R319–R321. PubMed:27115686. doi:10.1016/j.cub.2016.02.047. ISSN 0960-9822. Artikkelin verkkoversio.
- Center for Food Safety and Applied Nutrition: Daily Value on the New Nutrition and Supplement Facts Labels. FDA, 25.2.2022. Artikkelin verkkoversio. en
- Suomalaiset ravitsemussuositukset 2014, s. 49, 51. 5. painos. Valtion ravitsemusneuvottelukunta, 2018. ISBN 9789524538015. Teoksen verkkoversio.
- "Vitamin B12 deficiency in the elderly" (2021-11-18). Annual Review of Nutrition 19: 357–377. doi:. PMID 10448529.
- L Valsta et al: Ravitsemus Suomessa - FinRavinto 2017 -tutkimus, s. 61, 108. Terveyden ja hyvinvoinnin laitos, 2018. ISBN 9789523432383. Teoksen verkkoversio.
- Overview on Tolerable Upper Intake Levels as derived by the Scientific Committee on Food (SCF) and the EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA) (pdf) EFSA. 2018. Viitattu 6.3.2019.
- J Zempleni et al: Handbook of vitamins, s. 414–445. 4. painos. Taylor & Francis, 2007. ISBN 9780849340222.
- H Wang et al: Oral vitamin B12 versus intramuscular vitamin B12 for vitamin B12 deficiency. The Cochrane Database of Systematic Reviews, 2018, 15. vsk, nro 3. PubMed:29543316. doi:10.1002/14651858.CD004655.pub3. ISSN 1469-493X. Artikkelin verkkoversio.
- Cyanocobalamin material safety data sheet 2.7.2012. Sigma Aldrich. Arkistoitu 6.9.2019. Viitattu 11.5.2019.
- R Fatima, M Aziz: Achlorhydria. StatPearls Publishing, 2019. Teoksen verkkoversio (viitattu 17.5.2019).
- K Marinou: Long term metformin use association with vitamin B12 deficiency and anemia. Journal of Diabetes, Metabolic Disorders & Control, 2017, 4. vsk, nro 1. doi:10.15406/jdmdc.2017.04.00102. Artikkelin verkkoversio.
- C Briani et al: Cobalamin deficiency: clinical picture and radiological findings. Nutrients, 2013, 5. vsk, nro 11, s. 4521–4539. PubMed:24248213. doi:10.3390/nu5114521. ISSN 2072-6643. Artikkelin verkkoversio.
- Methylmalonic acid: reference range, interpretation, collection and panels. medscape.com, 2018. Artikkelin verkkoversio.
- NIH Intramural Sequencing Center Group, Jennifer L Sloan, Jennifer J Johnston, Irini Manoli, Randy J Chandler, Caitlin Krause: Exome sequencing identifies ACSF3 as a cause of combined malonic and methylmalonic aciduria. Nature Genetics, 2011-09, 43. vsk, nro 9, s. 883–886. PubMed:21841779. doi:10.1038/ng.908. ISSN 1061-4036. Artikkelin verkkoversio. en
- Monique G. M. de Sain-van der Velden, Maria van der Ham, Judith J. Jans, Gepke Visser, Hubertus C. M. T. Prinsen, Nanda M. Verhoeven-Duif: A New Approach for Fast Metabolic Diagnostics in CMAMMA, s. 15–22. Berlin, Heidelberg: Springer Berlin Heidelberg, 2016. ISBN 978-3-662-53680-3, 978-3-662-53681-0. Teoksen verkkoversio.
- Histidine Catabolism qmul.ac.uk.
- Combs, s. 528–560
- ME Ensminger et al: ”Chapter 6 F”, The concise encyclopedia of foods & nutrition. CRC Press, 1995. ISBN 9780849344558.
- F Watanabe et al: Vitamin B12-containing plant food sources for vegetarians. Nutrients, 2014, 6. vsk, nro 5, s. 1861–1873. PubMed:24803097. doi:10.3390/nu6051861. ISSN 2072-6643. Artikkelin verkkoversio.
- Tempeh fdc.nal.usda.gov. Viitattu 14.7.2020.
- Combs, s. 59
- B Caballero et al: ”Volume 4”, Encyclopedia of human nutrition, s. 351–356. 3. painos. Elsevier, 2013. ISBN 9780123750839.
- M Eggersdorfer et al: ”Vitamins”, Ullmann's Encyclopedia of Industrial Chemistry, s. 103–110. American Cancer Society, 2000. ISBN 9783527306732. Teoksen verkkoversio.
- Combs, s. 40–41
- CG Acevedo-Rocha et al: Microbial cell factories for the sustainable manufacturing of B vitamins. Current Opinion in Biotechnology, 2019, 56. vsk, s. 18–29. PubMed:30138794. doi:10.1016/j.copbio.2018.07.006. Artikkelin verkkoversio.
- Obeid, s. 180
- S Surendran et al: An update on vitamin B12-related gene polymorphisms and B12 status. Genes & Nutrition, 2018, 13. vsk, nro 2. PubMed:29445423. doi:10.1186/s12263-018-0591-9. ISSN 1555-8932. Artikkelin verkkoversio.
- B12-vitamiini, seerumista huslab.fi. Viitattu 16.5.2019.
- T Addison: Anæmia – disease of the supra-renal capsules. London Medical Gazette, 1849, 43. vsk, s. 517–518. ISSN 1356-1685. Artikkelin verkkoversio.
- JP Greer et al: Wintrobe's clinical hematology, s. 2140. 13. painos. Lippincott Williams & Wilkins, 2014. ISBN 9781451172683.
- MA Biermer: Eine eigenthümliche form von progressiver perniciöser anämie. Correspondenz-Blatt für Schweizer Ärzte, 1872, 2. vsk, s. 15–18. ISSN 0366-5461. Artikkelin verkkoversio.
- P Burman: Autoimmune gastric disease chemical and clinical studies with special reference to H+, K+-ATPase. Upsala Journal of Medical Sciences, 1991, 96. vsk, nro 3, s. 149–175. PubMed:1667236. doi:10.3109/03009739109179268. ISSN 0300-9734. Artikkelin verkkoversio.
- Definition of PERNICIOUS merriam-webster.com. Viitattu 23.5.2019.
- W Gardner, W Osler: A case of progressive pernicious anemia (idiopathic of Addison). Canada Medical and Surgical Journal, 1877, 5. vsk, nro 9, s. 385-404. ISSN 0319-6054. Artikkelin verkkoversio.
- G Hayem: Recherches sur l’évolution des hématies dans le sang de l’homme et des vertébrés. Archives de physiologie normale et pathologique, 1878, 5. vsk, s. 692–734. ISSN 0150-9748. Artikkelin verkkoversio.
- P Erlich: Über regeneration und degeneration der rothen blutscheiben bei anämien. Berliner klinische Wochenschrift, 1880, 17. vsk, nro 23, s. 405. ISSN 0366-0974. Artikkelin verkkoversio. (Arkistoitu – Internet Archive)
- L Lichtheim: Zur Kenntnis der perniciösen anämie. Verhandlungen des Deutschen Kongress für innere Medizin, 1887, 6. vsk, s. 84–99. ISSN 0070-4067. Artikkelin verkkoversio.
- WP Murphy, GR Minot: Treatment of pernicious anemia by a special diet. Journal of the American Medical Association, 14.8.1926, 87. vsk, nro 7, s. 470–476. PubMed:11769340. doi:10.1001/jama.1926.02680070016005. ISSN 0002-9955. Artikkelin verkkoversio.
- JM Scott, AM Molloy: The discovery of vitamin B(12). Annals of Nutrition & Metabolism, 2012, 61. vsk, nro 3, s. 239–245. PubMed:23183296. doi:10.1159/000343114. ISSN 1421-9697. Artikkelin verkkoversio.
- JH Jandl: Biographical memoir of William B. Castle. National Academy of Sciences, 1995. Artikkelin verkkoversio.
- WB Castle: The Ætiological relationship of achylia gastrica to pernicious anæmia. Proceedings of the Royal Society of Medicine, heinäkuu 1929, 22. vsk, nro 9, s. 1214–1216. PubMed:19987070. ISSN 0035-9157. Artikkelin verkkoversio.
- EL Rickes et al: Crystalline vitamin B12. Science, 16.4.1948, 107. vsk, nro 2781, s. 396–397. PubMed:17783930. doi:10.1126/science.107.2781.396. ISSN 0036-8075. Artikkelin verkkoversio.
- EL Smith: Purification of anti-pernicious anæmia factors from liver. Nature, 24.4.1948, 161. vsk, nro 4095, s. 638–639. PubMed:18856623. doi:10.1038/161638a0. ISSN 1476-4687. Artikkelin verkkoversio.
- WFK Cuthbertson, JE Page: Ernest Lester Smith. 7 August 1904-6 November 1992. Biographical Memoirs of Fellows of the Royal Society, 1994, 40. vsk, s. 349–365. ISSN 0080-4606. Artikkelin verkkoversio.
- K Folkers et al: Vitamin B12: reactions of cyano-cobalamin and related compounds. Science, 29.9.1950, 112. vsk, nro 2909, s. 354–355. PubMed:14781759. doi:10.1126/science.112.2909.354-a. ISSN 0036-8075. Artikkelin verkkoversio.
- FH Bethell et al: Cobalamin (vitamin B12) and the intrinsic factor of Castle. Annals of Internal Medicine, 1.9.1951, 35. vsk, nro 3, s. 518. PubMed:14868999. doi:10.7326/0003-4819-35-3-518. ISSN 0003-4819. Artikkelin verkkoversio.
- DC Hodgkin et al: Structure of vitamin B12. Nature, 14.7.1956, 178. vsk, nro 4524, s. 64–66. PubMed:13348621. doi:10.1038/178064a0. ISSN 0028-0836. Artikkelin verkkoversio.
- RB Woodward: The total synthesis of vitamin B12. Pure and Applied Chemistry, 1973, 33. vsk, nro 1, s. 145–177. PubMed:4684454. doi:10.1351/pac197333010145. ISSN 0033-4545. Artikkelin verkkoversio.
- Albert Eschenmoser The Franklin Institute. 15.1.2014. Arkistoitu 14.2.2017. Viitattu 17.5.2019.
Aiheesta muualla
- Fineli: B12-vitamiini lähteet ruoka-aineissa.
- Linus Pauling Institute: Vitamin B12 (englanniksi)
- HMDB: Cyanocobalamin (englanniksi)
- KEGG: Cyanocobalamin (englanniksi)