Kaasuräjähdys
Kaasuräjähdys on räjähdys, jossa suuri määrä kemiallisia yhdisteitä reagoivat keskenään ja sen teho perustuu lämpöenergian vapautumiseen sekä kaasumaisten tuotteiden muodostumiseen. Kaasuräjähdys tapahtuu reaktionopeuden kasvaessa sopivissa olosuhteissa yhä nopeammin niin, että lopputuotteita muodostuu kiihtyvällä nopeudella. Tätä jatkuu kunnes lähtöaineet ovat reagoineet loppuun. Räjähdykseen liittyy tyypillisesti reaktiolämpötilan nousu, joka aiheutuu eksotermisten reaktioiden alati lämmittävästä vaikutuksesta ja paineen kasvu. Näistä voi yhdessä muodostua tuhoava vaikutus. Räjähdykseen liittyy kaksi mekanismia: 1. terminen räjähdys, kun reaktion eksotermisyys aiheuttaa reaktiolämpötilan nousun ja yhä suuremmat nopeusvakiot, ja 2. ketjureaktion haarautumisen aiheuttama räjähdys, jossa ketjureaktion jossain vaiheessa yhdestä lähtöaineesta muodostuu kaksi ketjunkantajaa ja samalla kokonaisreaktionopeus kasvaa.
Terminen räjähdys
Terminen räjähdys tapahtuu kun eksotermisista reaktioista vapautuva lämpö ei siirry johtumisen, lämmön kuljetuksen tai säteilyn toimesta riittävän nopeasti pois reaktiojärjestelmästä. Olkoon lämmön muodostumisen nopeus astiassa vakiotilavuudessa , missä on kokonaisnopeus ja on sisäenergian muutos. Oletetaan asian yksinkertaistamiseksi lämpötilan olevan sama koko tilavuudessa.[1] Tällöin lämmön häviämisen nopeus voi olla
Tässä verrannollisuuskertoimena on aineen lämmönjohtavuus, on lämpötila astian seinällä, ovat lämmön siirtymiseen liittyvät pinta-ala ja kerroksen paksuus. Yhtälöstä on todettavissa, että lämmön häviämisen nopeus on suoraan verrannollinen lämpötilaan kun taas lämmön muodostumisen nopeus riippuu eksponentiaalisesti lämpötilasta nopeusvakioiden lämpötilariippuvuuden takia.
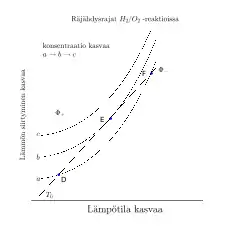
Viereisessä kuvassa on tilanteet a, b ja c. Käyrällä a aluksi kun astiassa oleva kaasu lämpiää D-pisteeseen saakka. Tässä pisteessä ja on olemassa terminen tasapainotila. Käyrän a F-pisteessä lämmön muodostuminen eksotermisistä reaktioista ylittää taas lämmön siirtymisen pois reaktioastiasta ja reaktiseos voi syttyä. Käyrällä c pätee aina , jolloin reaktioseoksen lämpötila jatkuvasti nousee ja reaktionopeus kasvaa johtaen termiseen räjähdykseen. Kolmannessa tilanteessa (b-käyrä) on olemassa E-pisteessä kriittinen lämpötila, joka vastaa räjähdysrajaa. Tätä korkeammissa konsentraatioissa terminen räjähdys on läsnä kun taas alemmissa konsentraatioissa kaasureaktiot tapahtuvat lähes isotermisesti. Huomatkoon, että E-pisteessä lämpötuotto ja -häviö ovat yhtäsuuret:
Terminen räjähdys ei tarvitse tapahtuakseen ketjureaktioiden läsnäoloa.
Ketjureaktion haarautuminen
Normaalissa ketjureaktiossa propagaatiovaiheessa yksi radikaali korvautuu toisella, joten radikaalikonsentraatio on vakio ja samoin kokonaisreaktionopeus. Toisaalta kun jokin ketjun vaihe haarautuu tuottaen lisää ketjunkantajina olevia radikaaleja, on kyseessä radikaalien konsentraation kasvu ja kokonaisreaktionopeuden voimakas suurentuminen. On kuitenkin otettava huomioon, että omatoiminen (spontaani) räjähdys edellyttää ketjureaktion eksotermisyyttä, joten käytännössä ketjuhaarautumisen aiheuttamassa räjähdyksessä on läsnä myös terminen komponentti. Tarkastellaan seuraavassa ketjureaktion haarautumista vety/happi-reaktiojärjestelmässä.[2]
Kokonaisreaktio on
Tämä reaktio on eksoterminen (229 kJ mol-1 yhtä vesimoolia kohti), mutta ei tapahdu ilman radikaalin (atomin) läsnäoloa. H- ja O-atomit muodostuvat dissosiaatioreaktion seurauksena esim. tuotetusta sähköisestä purkauksesta. Tämän prosessin nopeutta merkitään :llä. Kokonaisreaktion mekanismi on (reaktiopaine on pieni, M = puskurikaasumolekyyli ja W = astian seinän mahdollistama heterogeeninen reaktio, tarkan mekanismin tarkasteluun tarvitaan 40 alkeisreaktiota):
- (0)initiaatio (alkuvaihe)
- (0)initiaatio (alkuvaihe)
- (2)ketjun haarautuminen
- (3)ketjun haarautuminen
- (1)propagaatio (ketjun jatkuminen)
- (4)terminaatio (päättyminen)
- (5)terminaatio (päättyminen)
Reaktiovaiheessa (0) H-atomeja muodostuu helpommin kuin O-atomeja, koska vedyn sidosvoimakkuus on pienempi kuin hapen. Kumpikin dissosoitumisreaktio on endoterminen. H-atomi toimii pääasiallisena ketjunkantajana. Edellä olevissa reaktiovaiheissa (2) ja (3) tapahtuu ketjureaktion haarautuminen, jossa radikaalien määrä kaksinkertaistuu. Reaktiovaihe (1) on tavanomainen ketjureaktiovaihe, jossa radikaalien määrä on vakio. Ketjureaktio päättyy terminaatioon, jossa H-atomit muodostavat vetyä heterogeenisesti tai reagoivat hapen kanssa termolekulaarisessa reaktiossa. Siinä muodostuva tuote HO2-radikaali, jonka läsnäolo vety/happi-liekissä on spektroskooppisesti todettu, on reagoimaton vedyn ja hapen kanssa matalissa lämpötiloissa.
Vety/happi-reaktioiden differentiaaliyhtälöt
Ketjureaktion H-atomin konsentraation muutokselle voidaan kirjoittaa[2]
Vastaavasti voi kirjoittaa OH-radikaalille ja O-atomille:
Sekä OH- että O-radikaalien konsentraation muutoksille voidaan käyttää vakiotilaoletusta. Vastaavaa EI voi tehdä merkittävimpänä ketjunkantajana olevalle H-atomille, koska sen konsentraation muuttuu ajan funktiona suuresti. Reaktiovaihe (2) on noin 70 kJ mol-1 endoterminen ja reaktiovaihe (3) noin 10 kJ mol-1 endoterminen. Näistä jälkimmäinen reaktio on paljon nopeampi kuin edellinen:
Vakiotilaolosuhteissa voidaan laskea:
Sijoittamalla nämä lausekkeet :n nopeuslakiin, saadaan:
Merkitään, että pääasiallinen ketjunkantaja , ketjureaktion haarautumista esittävä , ja terminaatiota esittävä . Differentiaaliyhtälö saadaan yksinkertaistettua muotoon:
Tämä voidaan integroida raja-arvojen ollessa ketjureaktion alussa ja ja ketjureaktion aikana ne ovat :
Ratkaisuksi saadaan
Tälle yhtälölle on kaksi ratkaisua (ks. kuva):
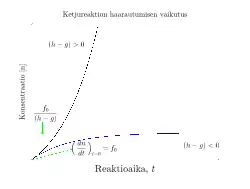
- 1) , jolloin terminaatio on suurempi kuin ketjureaktion haarautumisvaihe mikä toteutuu riittävän alhaisilla hapen osapaineilla ja yhtälön eksponenttiosa lähestyy nopeasti nollaa. Tällöin vakiotilaoletus pätee ja lähestyy asymptoottisesti arvoa .
- 2) , jolloin ketjun haarautumisvaihe tapahtuu nopeammin kuin terminaatio ja ketjunkantajia muodostuu yhä enemmän, mikä johtaa radikaalin konsentraation eksponentiaaliseen kasvuun. On arvioitavissa, että yksi H-atomikeskus aiheuttaa 0,3 sekunnissa 1015 uutta H-atomia kun lämpötila on 800 K ja hapen osapaine 11 kPa. Näin nopea radikaalikonsentraation kasvu näkyy käytännössä räjähdyksenä.
Paineen ja lämpötilan vaikutus
Vety/Happi-kaasuseoksen räjähtäminen riippuu sekä lämpötilasta että paineesta. Reaktioseos ei räjähdä kun reaktiolämpötila on alle 400 oC, mutta voi räjähtää kun lämpötila ollessa suurempi kuin 460 oC. Räjähdys aiheutuu myös ketjureaktioiden haarautumisesta, mikä toisaalta edellyttää reaktiopaineen kasvua tapahtuakseen.
Vety/Happi-kaasuseoksen reaktioihin on kokonaispaineella keskeinen vaikutus (ks. kuva).
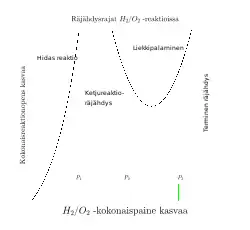
Kokonaispaineen ollessa paljon pienempi kuin (on noin 500 Pa), terminaatio hallitsee. Kun kokonaispaine vastaa ensimmäistä kriittistä painetta, , ketjureaktion haarautumisen osuus muodostuu yhä merkittävämmäksi tekijäksi. Tällöin isoterminen räjähdys tapahtuu ketjunkantajien konsentraatioiden kasvaessa.[3] Tähän voi ilmentyä detonaationa, jossa palavan kaasuseoksen eturintama etenee nopeudella 1000 m s-1. Kokonaispaineen vielä kasvaessa reaktiot tapahtuvat ketjuräjähdysalueella.
Kun kokonaispaine edelleen kasvaa, niin ketjuräjähdys tyrehtyy (toinen kriittinen paine, on n. 13 kPa) termolekulaarisen reaktiovaiheen (5) tullessa yhä merkittävämmäksi. Samalla siirrytään vety/happi-liekkipalamisen alueelle, jossa matalissa lämpötiloissa verrattain verkkaisesti reagoiva HO2-radikaali on yksi tärkeimmistä radikaaleista vety/happi-kaasuseoksen reaktioissa. Tällä alueella tulevat merkittäviksi myös HO-radikaalin reaktiot. Vuonna 1937 saksalainen ilmalaiva Hindenburg tuhoutui Lakehurst:ssa (New Jersey, USA) liekkipalamisen alueella. Ilmalaivan harusvaijeri oli laskeutumisvaiheessa vaurioittanut ulkopintaa, jonka seurauksena vetyä alkoi vuotaa ilmalaivan kaasulohkosta ulkoilmaan. Laskeutumisaikana vallitsi ukonilma, jonka seurauksena ilmalaivan ulkopinta oli ilmeisesti sähköisesti varautunut. Kun mastoon telakoitumiseen tarkoitettu harusvaijeri maadottui, oikosulku aikaansai kipinän, joka sytytti muodostuneen vety/happi-kaasuseoksen. Palo eteni aluksi pintapalona, koska kitkan pienentämiseksi ilmalaiva oli päällystetty helposti palavalla nitroselluloosalakalla. Pintapalon leviäminen vapautti lisää vetyä muista kaasulohkoista liekkipaloon ja ilmalaiva alkoi palamaan soihdun tavoin mutta ei räjähtänyt.
Kun kokonaispaine on hyvin suuri, se vastaa kolmatta kriittistä painetta, . Tällöin eksotermisistä reaktioista vapautuva lämpö ja muut termiset prosessit aikaansaavat reaktioseoksen lämpötilan kasvun ja samalla myös endotermisten reaktioiden vaikutuksien lisääntymisen. Tällöin yhä enemmän OH-radikaaleja muodostuu suoraan vetyperoksidin dissosioituessa. Tämä mahdollistaa [H]:n kasvun propagaatiovaiheen kautta ja edelleen ketjureaktioiden haarautumisreaktiot. Lämmön vapautumisesta seuraa lopulta terminen räjähdys. Avaruussukkula Challengerin tuho tapahtui ilmeisesti termisenä räjähdyksenä, kun kiinteän polttoaineen korkeapaineinen liekkisuihku pääsi tunkeutumaan vety/happi-säiliöön rikkoutuneen O-renkaan kautta ja sytytti nestemäisen kaasuseoksen räjähdysmäisesti.
Leimahdus
Epätäydellisestä räjähdyksestä, leimahduksesta, käytetään nimitystä deflagraatio. Se on aliääninen palamisreaktio, jossa liekkirintama etenee polttoaine-happi -seoksen läpi nopeudella noin 1 m s-1. Palamisreaktioista vapautuva lämpöenergia siirtyy kuumasta kaasukerroksesta viereiseen kylmään kaasukerrokseen verrattain hitaasti kuumentaen sen ja tämä lämpö siirtyy edelleen eteenpäin. Lämpöenergian siirtymisen seurauksena tapahtuu kaasuseoksen syttyminen. Lämpöenergian muodostumista hyödynnetään lämpövoimakoneessa. Aseruudin, ilotulitteen ja kaasu-uunin kaasun palaminen ovat esimerkkejä deflagraatiosta.
Detonaatio
Detonaatio on eksoterminen kemiallinen palamisreaktio, johon liittyy hyvin voimakas paineen muutoksesta johtuva shokkiaallon eteneminen ja merkittävä reaktiolämpötilan nousu räjähtävässä aineessa.[4][5] Detonaatio voi tapahtua kaasuseoksessa, kiinteässä aineessa tai nesteessä. Näistä kaasuseoksessa, joka koostuu palavasta aineesta ja hapettimesta, shokkiaallon nopeus on pienin. Detonaatiota on selitetty yksiulotteisella mallilla, jossa aluksi hyvin ohut shokkiaalto aiheuttaa räjähtävien aineiden paikallisen konsentroitumisen. Tämä äkkinäinen paikallinen paineen muutos mahdollistaa kemiallisten ketjureaktioiden tapahtumisen ja reaktioiden lämpöenergian vapautumisen, jonka seurauksena taas tapahtuu shokkiaaltoon nähden vastakkaissuuntaista ainevirtausta pienemmällä virtausnopeudella ja ketjureaktioiden keskeytymisillä.[6]
Detonaatiossa räjähdysaineiden räjähdysnopeus on yli 1000 m s-1 ja ruutien sekä tuleen leimahtavien aineiden tyypillisesti n. 100 m s-1. Räjähdysnopeus riippuu räjähdysmateriaalista. Esimerkiksi pentriitillä (2,2-bis(hydroksimetyyli)-1,3-propaanidioli, pentaerytritolitetranitraatti) räjähdysnopeus on 4000 - 7000 m s-1. Tätä ilmiötä käytetään hyväksi räjähtävässä tulilangassa. Uusissa polttomoottoreissa ilmiötä hyödynnetään hyödynnetään sytyttämällä polttoaine-ilmaseos useasta pisteestä (esim. Twin Spark-moottori), jolloin polttoaineen palaminen on yhä täydellisempää. Vastaavasti panostetussa metalliputkessa räjähdyspanos sytytetään putken molemmissa päissä yhtä aikaa, jolloin vastakkaissuuntaisten iskuaaltojen vaikutuksista muodostuu ns. saksi-ilmiö. Tämä tapahtuma katkaisee putken. Huonolaatuisen tai vanhentuneen räjähdysaineen epähomogeenisuus estää aaltoa etenemästä joka suuntaan samalla nopeudella ja täten heikentäen räjähdystä. Tässä tapauksessa räjähdysainetta voi jäädä reagoimatta epävakaaseen tilaan aiheuttaen merkittävän turvallisuusriskin.
Katso myös
- Reaktiokinetiikka
- Arrheniuksen yhtälö
- Alkeisreaktio
- Autokatalyysi
- Ketjureaktio
- Kylmäliekkipalaminen
- Kuumaliekkipalaminen
Lähteet
- Michael J. Pilling ja Paul W. Seakins, Reaction Kinetics, (1976), Oxford University Press, ISBN 0-19-8555528-8
- Jeffrey I. Steinfeld, Joseph S. Francisco, ja William L. Hase, Chemical Kinetics and Dynamics, 2. painos, (1998), Prentice Hall, ISBN 0-13-737123-2
- N. N. Semenov, Some Problems in Chemical Kinetics and Reactivity, 2. painos, (1958), Pergamon, ISBN 978-1-4831-6747-3
- H. B. Dixon, Philos. Trans., vol 175 (1884) s. 617
- David L. Chapman, Philos. Mag., vol 47(5) (1899) s. 90
- John von Neumann, Collected Works, 1903–1957 vol 6, sivut 178-218, Pergamon Press., ISBN 978-0-08-009566-0