Kemiallinen oskillaatio
Kemiallinen oskillaatio on monimutkainen kemiallinen järjestelmä joka koostuu useasta autokatalyyttisestä reaktiovaiheesta. Tavallisesti kemiallinen järjestelmä saavuttaa tasapainotilan eksponentiaalisen vaimenemisen (relaksoitumisen) kautta, mutta sopivissa olosuhteissa reaktion välituotteiden konsentraatiot voivat oskilloida järjestelmän usean eri vakiotilan välillä.
Termodynamiikan toisen lain mukaan vapaaehtoiset kemiallisten järjestelmien muutokset suljetussa tilassa tapahtuvat Gibbsin vapaaenergian pieneneminen aikana ja vakiolämpötilassa ja -paineessa järjestelmä pyrkii monotonisesti kohti tasapainotilaansa ilman edestakaista vaihtelua. Järjestelmän välituotteiden konsentraatiot voivat kuitenkin oskilloida jos yksi ainesosa siinä on reaktion kiihdyttäjä tai hidastaja. Tällöin reaktiolle (so. järjestelmä) aiheutuu kemiallinen takaisinkytkentä (engl. feedback). Jos reaktio on kaukana tasapainotilastaan edesauttaa Gibbsin vapaaenergian pieneneminen oskillaation tapahtumisen. Kun reaktion tasapainotila lopulta saavutetaan, niin oskillaatio vaimenee pois. Kemiallinen oskillaattori käyttäytyy jaksollisesti tilassa ja ajassa. Oskillaatiota on useimmiten havaittavissa liuosfaasissa.
Oskillaatiomekanismi
Tarkastellaan avointa kemiallista järjestelmää, jonka kaikki reaktiovaiheet ovat palautumattomia, irreversiibeleitä:[1]
- (1)
- (2)
- (3)
Tämä järjestelmä on Lotka-mekanismi.[2] Reaktiovaiheet (1) ja (2) ovat autokatalyyttisiä. Järjestelmässä :n konsentraatio pidetään yhtä suurena kuin sen konsentraatio reaktion alussa.
Välituotteille ja voidaan soveltaa vakiotilaoletusta ja niiden nopeuslaeiksi voidaan kirjoittaa:
- (4)
- (5)
Soveltamalla vakiotilaoletusta saadaan yhtälöt (6) ja (7):
- (6)
- (7)
Yhtälöistä (6) ja (7) on todettavissa, että vakiotilakonsentraatiot eivät ole reaktioajasta riippuvaisia.
Relaksointimenetelmän sovellus
Häiritään vakiotilaa muuttamalla konsentraatioiden vakiotila-arvoja samankaltaisesti kuin on toteutettu reversiibelille alkeisreaktiolle. Tällöin välituotteiden konsentraatiot ovat: ja . Nämä sijoittamalla yhtälöistä (4) ja (5) saadaan:
- (8)
- (9)
Jos poikkeama vakiotilasta on vähäinen, niin tulo on hyvin pieni ja se voidaan jättää pois differentiaaliyhtälöistä. Tällöin saadaan ensimmäisen kertaluvun lineaarinen differentiaaliyhtälöpari:
- (10) ja
Kirjoittamalla ja saadaan toisen kertaluvun differentialiyhtälöksi:
- (11)
Yhtälö (11) voidaan ratkaista käyttämällä arvausta (saks. ansatz) kuten on odotettavissa 1. kertaluvun keskimääräiselle elinajalle. Sijoittamalla tämä yhtälöön (11) saadaan
- (12)
Tämän juuret ovat , joten yleinen ratkaisu on juurien lineaarikombinaatio
- (13)
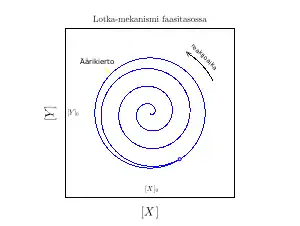
Yhtälö (13) funktio oskilloi kuten .[lower-alpha 1] Käytännössä tämä tarkoittaa sitä, että häirittäessä vakiotilaa järjestelmä ei relaksoidu aikaisempaan tilaansa vaan järjestelmän välituotteiden konsentraatiot oskilloivat ja nämä muutokset voivat jopa suurentua aina johonkin arvoon, joka on järjestelmän äärikierto (engl. limit cycle). Tämä on esitetty Lotka-mekanismina viereisessä kuvassa.
Jos reaktiovaiheet (1) – (3) ovat palautuvia kuten 1. kertaluvun tasapainoreaktiossa, järjestelmä ei oskilloi. Käytännön esimerkkinä oskilloivasta järjestelmästä on kylmäliekkipalaminen ja Belousov-Zhabotinskii -reaktiossa malonihapon ja bromaatti-ionin välinen hapetus-pelkistysreaktio rikkihappoliuoksessa, jota katalysoidaan esim. cerium-ionilla.[3][4] Nämä ovat esimerkkejä negatiivisesta takaisinkytkennästä. Esimerkki positiivisesta takaisinkytkennästä on kaasuräjähdys.
Huomautukset
- Eulerin lauseessa
Lähteet
- Jeffrey I. Steinfeld, Joseph S. Francisco, ja William L. Hase, Chemical Kinetics and Dynamics, 2. painos, (1998), Prentice Hall, ISBN 0-13-737123-2
- A. J. Lotka, J. Phys. Chem., vol 14, (1910), sivu 271
- B. P. Belousov, Sb. Ref. Radiat. Med., vol 1, (1959), sivu 145
- A. M. Zhabotinskii, Dokl. Akad. Nauk SSSR, vol 157, (1964), sivu 392