Keletrooppinen reaktio
Keletrooppinen reaktio eli kelotrooppinen reaktio on perisyklinen orgaaninen reaktio, jossa elektronit liikkuvat syklisessä muodostelmassa muiden perisyklisten reaktioiden tavoin, jolloin joko muodostuu tai avautuu rengasrakenne. Muihin perisyklisiin reaktioihin verrattuna keletrooppinen reaktio eroaa kuitenkin siten, että konjugoidussa systeemissä reagoivat orbitaalit HOMO ja LUMO ovat yhden ja saman atomin orbitaaleja, eivät molekyyliorbitaaleja. Keletrooppisissa additioissa vähenee π-sidosten lukumäärä yhdellä ja liittyvän atomin koordinaatioluku kasvaa, kun se muodostaa kaksi uutta σ-sidosta. Tälle käänteisissä reaktioissa eli keletrooppisissa eliminaatioissa π-sidosten lukumäärä kasvaa ja poistuvan atomin koordinaatioluku pienenee.[1][2][3][4][5][6]
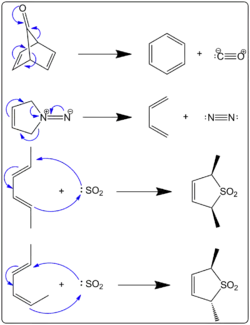
Mekanismi ja reaktioita
Keletrooppiset additiot tapahtuvat tyypillisesti dieenin ja pienen molekyylin kuten typen, rikkidioksidin tai hiilimonoksidin välisenä reaktiona. Reaktiossa liittyvä molekyyli käyttää yhtä vapaata elektronipariaan ja tyhjää p-orbitaalia ja dieeni kahta π-orbitaalia.[6] Tyypillinen keletrooppinen additioreaktio on myös karbeenien additioreaktio alkeeneihin[4].
Keletrooppisten eliminaatioiden ajavana voimana toimii pienten kaasumaisten molekyylien, kuten typen, rikkidioksidin tai hiilimonoksidin eliminoituminen. Irtoava ryhmä lähtee lämmitettäessä ja molekyylejä jotka reagoivat keletrooppisella eliminaatiolla ovat typpeä vapauttavat diatseenit, rikkidioksidia vapauttavat sulfoleenioksidit ja eräät bisykliset ketonit, joista eliminoituu hiilimonoksidia. Muodostuva tuote voi myös olla aromaattinen, mikä osaltaan ajaa reaktiota eteenpäin. Erityisesti sulfoleenioksidien keletrooppisia reaktioita käytetään hyväksi orgaanisessa synteesissä. Rikkidioksidin avulla voidaan dieeni suojata, jotta se ei reagoisi ei-toivotulla tavalla. Suojaus on keletrooppinen additio. Kun suojausta ei enää tarvita, voidaan tuotetta kuumentamalla eliminoida sulfoleenioksidista rikkidioksidi, jolloin dieeni vapautuu. Tämä on keletrooppinen eliminaatioreaktio.[3][4][5][6]
Muiden perisyklisten reaktioiden tavoin keletrooppiset reaktiot ovat hyvin selektiivisiä. Esimerkiksi cis-substituoidun sulfoleenioksidin keletrooppinen eliminaatio johtaa E,E-stereokemian omaavaan dieeniin ja trans-substituoidusta sulfoleenioksidista muodostuu E,Z-dieeni.[3]
Lähteet
- Cheletropic reaction IUPAC GoldBook. IUPAC. Viitattu 31.5.2014. (englanniksi)
- Leila Kotama ja Antti Kivinen: Suomalaisten Kemistien Seuran sanastotoimikunnan julkaisuja nro 5: Fysikaalisen orgaanisen kemian sanasto, s. 24. Suomen Kemian Seura, 1983. ISBN 951-9223-20-7. (englanniksi)
- Francis A. Carey & Richard J. Sundberg: Organic Chemistry B: Reactions and synthesis, s. 591–593. Springer, 2007. ISBN 978-0-387-68350-8. (englanniksi)
- Eric V. Anslyn, Dennis A. Dougherty: Modern physical organic chemistry, s. 924–927. University Science Books, 2006. ISBN 978-1-891389-31-3. Kirja Googlen teoshaussa (viitattu 31.5.2014). (englanniksi)
- Ian Fleming: Molecular Orbitals and Organic Chemical Reactions, s. 332. John Wiley & Sons, 2011. ISBN 978-1-119-96467-4. Kirja Googlen teoshaussa (viitattu 31.5.2014). (englanniksi)
- Nguyen Trong Anh: Frontier Orbitals, s. 72–74. John Wiley & Sons, 2007. ISBN 978-1-119-96467-4. Kirja Googlen teoshaussa (viitattu 31.5.2014). (englanniksi)