Kalsiumsitraatti
Kalsiumsitraatti on sitruunahapon kalsiumsuola. Sitä käytetään elintarvikkeiden happamuudensäätöaineena E-koodilla E333, mutta joskus myös makuaineena. Tässä suhteessa se on samankaltainen kuin natriumsitraatti. Kalsiumsitraattia voidaan käyttää myös veden pehmentämiseen, koska sitraatti-ionit kelatoivat ei-toivottuja metalli-ioneita. Kalsiumsitraattia löytyy myös lisäravinteista, joiden kokonaispainosta kalsiumia on 21 %.
| Kalsiumsitraatti | |
|---|---|
 |
|
| Tunnisteet | |
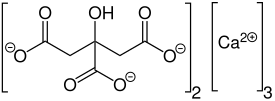
| IUPAC-nimi | 2-hydroksi-1,2,3-propaani-trikarboksyylihappo kalsiumsuola (2:3) |
| Muut nimet | E333 |
| CAS-numero |
813-94-5 5785-44-4 (tetrahydraatti) |
| SMILES | [Ca+2].[Ca+2].[Ca+2].O=C([O-])CC(O)(C([O-])=O)CC(=O)[O-].[O-]C(=O)C(O)(CC([O-])=O)CC([O-])=O |
| Ominaisuudet | |
| Molekyylikaava | Ca3(C6H5O7)2 |
| Moolimassa |
498.46 g/mol 570.5 g/mol (tetrahydraatti) |
| Ulkomuoto | Valkoinen pulveri |
| Sulamispiste | 120 °C (393.15 K) |
| Kiehumispiste | hajoaa |
| Tiheys | 1.63 g/cm3, kiinteä |
| Liukoisuus veteen |
0.085 g/100 mL (18 °C) 0.095 g/100 mL (25 °C) liukenematon alkoholiin |
Kemialliset ominaisuudet
Kalsiumsitraatti on hajutonta valkoista pulveria, joka ei liukene veteen. Kuten sitruunahappo, kalsiumsitraatti maistuu karvaalta. Se maistuu myös suolaiselta.
Tuotanto
Kalsiumsitraatti on eristämisen välivaihe fermentaatioprosessissa, jolla sitruunahappoa tuotetaan teollisesti.[1] Sitruunahappo liuoksesta neutraloidaan ja saostetaan kalsiumhydroksidilla. Saostuma suodatetaan ja pestään saaden puhdasta kalsiumsitraattia. Tämä kalsiumsitraatti voidaan myydä sellaisenaan tai muuttaa sitruunahapoksi laimealla rikkihapolla.
Biologinen rooli
Kalsiumsitraatin biosaatavuuden on todettu olevan samankaltainen edullisemman kalsiumkarbonaatin kanssa. Toisin kuin emäksinen kalsiumkarbonaatti, kalsiumsitraatti ei toimi antasidina. Tästä syystä mahan vähähappoisuudesta kärsivien tulisi ennemmin valita kalsiumsitraatti kalsiumlisäksi.
Lähteet
- "Use of Lime in the Chemical Industry". National Lime Association. Archived from the original on 2006-09-29. Retrieved 2006-11-25.
Aiheesta muualla
- PubChem: Calcium Citrate (englanniksi)
- ChemBlink: Calcium citrate (englanniksi)