Ioniselektiivinen elektrodi
Ioniselektiivinen elektrodi toimii galvaanisen kennon tavoin.[1] Kyseessä on potentiometrinen menetelmä, jossa mitataan sähköparien (anodi ja katodi) välistä jännitettä.
Määritelmä
Sähköpari syntyy, kun kaksi erilaista elektrodia, ioniselektiivinen elektrodi eli ISE (eng. ion-selective electrode) ja vertailuelektrodi, upotetaan analysoitavaan, ioneja sisältävään liuokseen. Vertailuelektrodin potentiaali on vakio, kun taas ioniselektiivisen elektrodin potentiaali riippuu mitattavan ionin aktiivisuudesta eli konsentraatiosta. Elektrodit yhdistetään toisiinsa mittalaitteistolla, jolloin mittalaitteen mittaamasta jännitteestä voidaan määrittää halutun ionin konsentraatio kalibraatiomenetelmällä.[2] Näiden kahden elektrodin välille muodostuu mitattavassa liuoksessa jännite, joka voidaan laskea Nernstin yhtälön avulla:
Jossa on standardipotentiaali,
R on moolinen kaasuvakio,
T on lämpötila,
z on siirtyvien elektronien lukumäärä,
F on Faradayn vakio ja
sekä ovat ioniaktiivisuudet.
Ioniselektiivisiä elektrodeja käytetään analyyttisessä kemiassa sekä biokemikaalisessa/biofysikaalisessa tutkimuksessa, jossa määritetään vesiliuosten ionipitoisuuksia. Elektrodien tärkein komponentti on ioniselektiivinen kalvo, jonka avulla anturi reagoi näytteessä selektiivisesti vain tiettyyn ioniin, vaikka liuoksessa olisi läsnä muitakin ioneja.[1]
Ioniselektiivisen elektrodin ominaisuuksia voidaan kuvata parametreilla kuten selektiivisyys, kalibrointikäyrän lineaarisen osan kaltevuus, lineaarisen vasteen alue, havaitsemisraja ja vasteaika. Selektiivisyys on yksi tärkeimmistä elektrodin ominaisuuksista, sillä sen avulla voidaan selvittää, kuinka paljon muut ionit (kuin se, jota halutaan mitata) vaikuttavat mitattavaan jännitteeseen. Selektiivisyyttä voidaan arvioida Nikolski-Shultsz-Eisenman -yhtälöllä, joka on johdettu Nernstin yhtälöstä [3][4]. Selektiivisyyskertoimet riippuvat ionien aktiivisuuksista ja käytetystä määritysmetodista. IUPAC eli kansainvälinen teoreettisen ja sovelletun kemian liitto suosittelee selektiivisyyden määrittämiseen SSM (separate solution method) ja FIM (fixed interference method) metodeja. Erilaisista metodeista voi lukea lisää IUPACin julkaisemasta raportista.[5] Nikolski-Shultsz-Eisenman -yhtälö kuvataan seuraavasti:
Jossa z on ionien varaus,
i on mittalaitteella mitattavan ionin kemiallinen kaava,
j on mittausta häiritsevän ionin kemiallinen kaava, ja
on selektiivisyyden kerroin. Mitä pienempi selektiivisyyskerroin, sitä pienempi on ionin (j) vuorovaikutus.
Kalibrointikäyrä määritetään kalibrointiliuosten avulla, ja se mitataan signaalina suhteessa analyytin aktiivisuuteen. Kalibrointikäyrän kaltevuuden pitää olla välillä 50–60 ioneilla, joiden varaus on +1 tai -1 ja 25–30 ionille, joiden varaus on +2 tai -2, Nernstin kaavalla laskettuna. Kalibrointikäyrän lineaarisella vastealueella tarkoitetaan pitoisuuksia, joita ISE pystyy tarkasti mittaamaan. Lineaarisen vasteen alue on yleensä M ja M välillä. Erittäin suuret tai alhaiset ioniaktiivisuudet voivat antaa poikkeavia tuloksia.[1]
Havaitsemisrajalla tarkoitetaan pienintä konsentraatiota, jota ISE pystyy mittaamaan.
Elektrodin kohdeionin havaitsemisrajaa nostavat häiritsevien ionien ja epäpuhtauksien läsnäolo mitattavassa liuoksessa. Useimpien elektrodien havaitsemisraja on M välillä (pH-elektrodeilla jopa M).
Vasteaika kertoo, kuinka kauan aikaa on mennyt elektrodin laittamisesta analyyttiin siihen, että laite on mitannut 90 % tarkkuudella loppuarvon. Yleensä vasteaika on muutaman minuutin luokkaa.[1]
Kalvotyypit
Ioniselektiivisellä elektrodilla on useita erilaisia kalvotyyppejä. Tässä artikkelissa määritellään kiinteät kalvot, lasielektrodi sekä nestekalvoelektrodi. Eri kalvotyypeillä voidaan määrittää eri ioneja, joten määritykseen käytettävä elektrodi valitaan analyysin mukaan.[6]
Kiinteät kalvot
Kiinteäkalvoisen ioniselektiivisen elektrodin vertailuelektrodin kalvo on kiinteää kiderakenteista materiaalia, joka koostuu liukenemattomasta epäorgaanisesta suolasta. Kiderakenteisella kalvolla on hyvä selektiivisyys, koska ainoastaan kiderakenteeseen liittymään kykenevät kationit tai anionit pääsevät läpäisemään kalvon.[7]
Esimerkiksi LaF3-kiderakenteesta muodostettua kalvoa voidaan käyttää F- -ionien konsentraation mittaamiseen. Tilanteessa syntyy tasapainoreaktio
jonka tasapaino siirtyy F- -ionien konsentraation vaikutuksesta, jolloin mitattava elektrodien välinen jännite muuttuu ja F- -ionien konsentraatio voidaan päätellä mitatusta jännitteestä kalibraatiokäyrän avulla.[7]
Lasielektrodi
Lasielektrodi (glass electrode) on tehty muunnellusta lasikalvosta (silikaatti tai kalkogenidi). On olemassa kaksi lasityyppiä; silikaattimatriisi, joka perustuu piidioksidin molekyyliverkkoon, johon on lisätty muita metallioksideja, esimerkiksi Na, K, Li, Al, B, Ca, ja kalkogenidimatriisi, joka perustuu AsS:n, AsSe:n ja AsTe:n molekyyliverkkoon. Lasielektrodilla on hyvä selektiivisyys, mutta vain muutamille yksivarauksisille katodeille; useimmiten H+, Na+ ja Ag+. Kalkogenidilasilla on selektiivisyyttä myös kaksivarauksisille metalli-ioneille, kuten Pb2+ja Cd2+. Tunnetuin esimerkki tämän tyyppisistä elektrodeista on pH-elektrodi, joka on herkkä vetyioneille. Lasielektrodeilla on iso merkitys kemiallisten analyysien ja fysikokemiallisten tutkimusten instrumentoinnissa.
pH-elektrodi
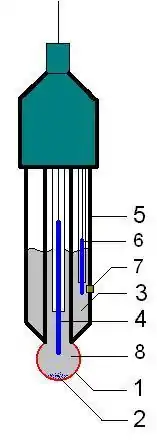
Ph-elektrodi koostuu kahdesta päällekkäisestä lasiputkesta, joiden kärjessä on lasikalvo ja sisällä HCl-liuosta. Lasikalvoon syntyy jännitehyppäys, jonka suuruus riippuu vetyionien aktiivisuuserosta sisäliuoksen ja mitattavan liuoksen välillä. Koska sisäliuoksen pH on vakio, jännite lasikalvon yli on verrannollinen mitattavan liuoksen pH-arvoon [8].
Lasikalvon ioninvaihto-ominaisuuden takia on mahdollista, että jotkut toiset ionit samanaikaisesti vuorovaikuttavat lasikalvon kanssa ja vääristävät lineaarista riippuvuutta mitatun elektrodipotentiaalin pH:ssa.
Esimerkkikaava Na+ liuoksen pH:n mittaamisesta pH-elektrodilla (Nikolski-Eisenman -yhtälö):
Lasielektrodin historia
Ensimmäiset tutkimukset lasielektrodeista toivat esiin erilaisissa laseissa erilaisia herkkyyksiä analyytin happamuuden muutoksiin, johtuen alkalimetalli-ionien vaikutuksista. Vuonna 1906 M. Cremer osoitti, että vastakkaisilla puolilla lasikalvoa olevien nesteiden välinen jännite on verrannollinen hapon konsentraatioon (vetyionien konsentraatio).[9] Vuonna 1922 W. S. Hughes osoitti, että alkali-silikaatti -lasielektrodit ovat samantyyppisiä vetyelektrodien kanssa, mutta käänteisiä koskien H+ ionia. [10]
Vuonna 1925 P. M. Tookey Kerridge kehitti ensimmäisen pH-elektrodin analysoimaan biokemiallisia näytteitä, kuten verinäytteitä. Hän kertoi tutkimuksen haasteena olleen muun muassa lasin korkea resistanssi (50 - 150 MΩ). [11] Tohtorintutkintonsa aikana Kerridge kehitti miniatyyri lasielektrodin. Hän maksimoi välineen pinta-alan lämpökäsittelemällä platinan platinakloridilla, ja näin mahdollistaen paljon suuremman jännitteen. Hänen suunnitelmansa on ollut edeltäjä monille nykyään käytettäville lasielektrodeille. [12][13]
Käyttökohteet
Lasielektrodeita hyödynnetään ioni-konsentraatioiden mittaamiseen monessa paikassa, kuten esimerkiksi teollisten prosessien valvonnassa, ruuan ja kosmetiikan analyysissa, ympäristöindikaattorien mittaamisessa, mikrobiologiassa (esim. solukalvojen jännitteen mittaamisessa) sekä maaperän happamuuden mittaamisessa.
Nestekalvoelektrodi
Nestekalvoelektrodi koostuu yleensä säiliöstä, jossa orgaaniseen liuottimeen on liuotettu molekyylejä, jotka pystyvät muodostamaan kompleksin tutkittavan ionin kanssa. Orgaaninen molekyyli voi olla ionofori (neutraali makrosyklinen ionikantaja) tai kationin/anioninen ioninvaihtaja.[14]
Nestekalvoelektrodeja käytetään etenkin kaksiarvoisien kationien, kuten Ca2+-ionien määritykseen. Nestekalvoelektrodi koostuu kationinvaihtajasta, joka on fosforihapon alifaattinen diesteri , jossa kukin R-ryhmä on alifaattinen hiilivetyketju, joka sisältää 8-16 hiiltä. Kationinvaihtaja liuotetaan orgaaniseen liuottimeen ja pidetään huokoisessa nestesäiliössä analyyttiliuoksen ja sisäisen vertailukalsiumkloridiliuoksen välissä. Ioninvaihtimen fosfaattiryhmällä on vahva affiniteetti Ca2+-ioniin, jolloin muodostuu kompleksiyhdiste, joka näkyy alla olevassa kuvassa. Kompleksinmuodostusreaktio muuttaa elektrodien välistä jännitettä, ja on verrannollinen Ca2+ ionikonsentraatioon liuoksessa. Nestesäiliötä käyttävä elektrodi voidaan säilyttää laimeassa analyyttiliuoksessa, eikä se tarvitse lisäkäsittelyä ennen käyttöä.[4]
Polymeerikalvoelektrodi
Vaihtoehtona nestemäisille kalvoelektrodeille on käyttää polymeerikalvoa, kuten polyvinyylikloridia (PVC), joka on kyllästetty orgaanisilla ioninvaihtajilla tai ioniforeilla. Näiden elektrodien vaste on erittäin selektiivinen ja ne ovat korvanneet monet nestekalvoelektrodit. Polymeerielektrodeja käytetään määrittämään ioneja, kuten K+, Ca2+, Cl- ja NO3-. PVC-kalvolla varustetun elektrodin käyttöikä on verrannollinen sen vesiliuoksille altistumiseen. Tästä syystä nämä elektrodit on parasta säilyttää peittämällä kalvo korkilla, joka sisältää pienen määrän kostutettua sideharsoa kostean ympäristön ylläpitämiseksi. Ennen mittausta elektrodi on vakautettava liuottamalla sitä analyyttiliuoksessa 30–60 minuuttia.[14]
Viitteet
- CHEMICAL SENSORS RESEARCH GROUP csrg.ch.pw.edu.pl. Viitattu 31.5.2022.
- Analyysimenetelmät 6.2. Potentiometria www03.edu.fi. Viitattu 31.5.2022.
- Denver G. Hall: Ion-Selective Membrane Electrodes: A General Limiting Treatment of Interference Effects. The Journal of Physical Chemistry, 1.1.1996, 100. vsk, nro 17, s. 7230–7236. doi:10.1021/jp9603039. ISSN 0022-3654. Artikkelin verkkoversio.
- A. A. Belyustin: Silver Ion Response as a Test for the Multilayer Model of Glass Electrodes. Electroanalysis, 1999-07, 11. vsk, nro 10-11, s. 799–803. doi:10.1002/(sici)1521-4109(199907)11:10/11<799::aid-elan799>3.0.co;2-x. ISSN 1040-0397. <799::aid-elan799>3.0.co;2-x Artikkelin verkkoversio.
- Yoshio Umezawa, Philippe Bühlmann, Kayoko Umezawa, Koji Tohda, Shigeru Amemiya: Potentiometric Selectivity Coefficients of Ion-Selective Electrodes. Part I. Inorganic Cations (Technical Report). Pure and Applied Chemistry, 1.1.2000, 72. vsk, nro 10, s. 1851–2082. doi:10.1351/pac200072101851. ISSN 1365-3075. Artikkelin verkkoversio.
- Gross, E. & Kelly, D. & Cannon Jr: Analytical Electrochemistry: Potentiometry. .
- Ion-Selective Electrodes Chemistry LibreTexts. 9.2.2017. Viitattu 31.5.2022. (englanniksi)
- Korhonen, Lassi: [Heureka.pdf Ph-anturin yleisohje] peda.net.
- Cremer, Max: Über die Ursache der elektromotorischen Eigenschaften der Gewebe, zugleich ein Beitrag zur Lehre von Polyphasischen Elektrolyketten, s. Z. Biol. 47:56. Oldenbourg, R., 1906.
- Hughes, W. S.: J. Am. Chem. Soc., J. Chem. Soc. Lond, s. 44, 2860, 491, 2860. , 1928.
- Yartsev, Alex: History of the Glass Electrode". Deranged Physiology. , Retrieved 26 June 2016.
- Blake-Coleman, Barrie: Phyllis Kerridge And The Miniature Ph Electrode. , Retrieved 26 June 2016.
- Kerridge, Phyllis Margaret Tookey: The Use of the Glass Electrode in Biochemistry". Biochemical Journal, s. 19 (4). , 1925.
- Liquid-Based Ion-Selective Electrodes - Potentiometric Methods of Analysis. Modern Analytical Chemistry BrainKart.