Homoseriini
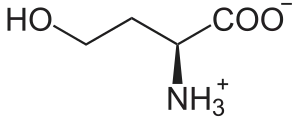
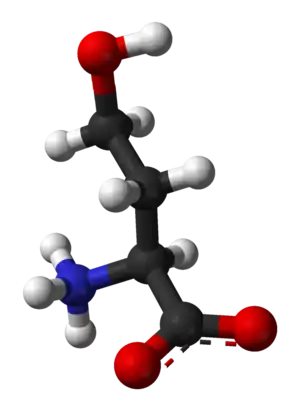
Homoseriini (C4H9NO3) on ei-proteinogeenisiin aminohappoihin eli proteiinisynteesiin osallistumattomiin aminohappoihin kuuluva orgaaninen yhdiste. Yhdistettä esiintyy kasveissa ja bakteereissa osana eräiden aminohappojen biosynteesiä. Homoseriinin rakenne poikkeaa seriinistä siten, että homoseriinissä on yksi CH2-yksikkö enemmän.
| Homoseriini | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | |
| IUPAC-nimi | 2-amino-4-hydroksibutaanihappo |
| SMILES | C(CO)C(C(=O)O)N[1] |
| Ominaisuudet | |
| Kemiallinen kaava | C4H9NO3 |
| Moolimassa | 119,122 g/mol |
| Sulamispiste | 203 °C (hajoaa)[2] |
| Liukoisuus | Liukenee veteen |
Ominaisuudet, biosynteesi ja biologinen rooli
Huoneenlämpötilassa homoseriini on valkoista kiteistä ainetta. Se liukenee erittäin hyvin veteen. Yhdiste on optisesti aktiivinen ja sen luonnossa esiintyvän enantiomeerin S-homoseriinin eli L-homoseriinin (CAS 672-15-1) ominaiskiertokyky 5 M vesiliuoksessa on -8,8. R-homoseriinin (CAS 6027-21-0) ominaiskiertokyky vesiliuoksessa on +8,8.[2] Homoseriinin raseemisen seoksen eli DL-homoseriinin CAS-numero on 1927-25-9.
Eliöt, jotka kykenevät tuottamaan homoseriiniä valmistavat sitä aspartaattisemialdehydistä homoseriinidehydrogenaasin katalysoimana. Homoseriinistä muodostuu treoniinia homoseriinikinaasin ja treoniinisyntaasin katalysoimana. Treoniinista voi muodostua edelleen isoleusiinia, joten homoseriini on myös isoleusiinin esiaste. Homoseriini on myös kolmannen aminohapon metioniinin biosynteesin esiaste. Kasveissa homoseriinistä muodostuu fosfohomoseriiniä homoseriinikinaasin katalysoimana ja tämä johdannainen kondensoituu kysteiinin kanssa kystationiiniksi, josta muodostuu edelleen metioniinia. Bakteereissa homoseriinistä muodostuu sen sijaan O-asetyylihomoseriiniä homoseriini-O-asetyylitransferaasin katalysoimana tai O-sukkinyylihomoseriiniä homoseriini-O-sukkinyylitransferaasin katalysoimana ja näistä välivaiheista muodostuu useamman vaiheen jälkeen metioniinia.[3][4][5]
Lähteet
- DL-Homoserine – Substance summary PubChem. NCBI. Viitattu 15.8.2015.
- Susan Budavari (päätoim.): Merck Index, s. 811. 12th Edition. Merck & Co., 1996. ISBN 0911910-12-3. (englanniksi)
- Volker F. Wendisch: Amino Acid Biosynthesis – Pathways, Regulation and Metabolic Engineering, s. 73, 166. Springer, 2007. ISBN 978-3-540-48595-7. Kirja Googlen teoshaussa (viitattu 15.8.2015). (englanniksi)
- Holger Zorn,Peter Czermak: Biotechnology of Food and Feed Additives, s. 197, 203. Springer, 2014. ISBN 978-3-662-43760-5. Kirja Googlen teoshaussa (viitattu 15.8.2015). (englanniksi)
- CIBA Foundation Symposium: Sulphur in Biology, s. 103. John Wiley & Sons, 2009. ISBN 978-0470718230. Kirja Googlen teoshaussa (viitattu 15.8.2015). (englanniksi)
Aiheesta muualla
- PubChem: L-homoserine (englanniksi)
- Human Metabolome Database (HMDB): L-Homoserine (englanniksi)
- DrugBank: L-Homoserine (englanniksi)
- Kyoto Encyclopedia of Genes and Genomes (KEGG): L-Homoserine (englanniksi)
- PubChem: D-Homoserine (englanniksi)