Proteiinien kvaternäärirakenne
Proteiinien kvaternäärirakenne on joidenkin proteiinien rakenteen ylin käsitteellinen taso. Kvaternääriset proteiinit ovat komplekseja eli ne koostuvat kahdesta tai useammasta eri proteiiniyksiköstä, jotka ovat toisissaan kiinni ei-kovalenttisesti tai kovalenttisesti disulfidisidoksin. Kukin yksikkö koostuu yhdestä polypeptidiketjusta. Vain yhden yksikön omaavalla proteiinilla ei ole kvaternäärirakennetta.[1] Kvaternäärisiä proteiineja sanotaan myös multimeerisiksi ja vain muutamia yksikköjä sisältäviä proteiineja sanotaan vaihtoehtoisesti myös oligomeerisiksi.[2]
Luokittelu
Jos proteiinissa on 2 erillistä polypeptidiketjua eli proteiiniyksikköä, proteiini on dimeeri; jos niitä on 3, proteiini on trimeeri (katso taulukko alla ja numeerinen etuliite). Jos yksiköt ovat keskenään erilaisia, proteiini on heteromeeri. Jos yksiköt ovat keskenään samanlaisia, proteiini on homomeeri. Näitä voidaan käyttää etuliitteinä hetero- tai homo-. Jos vaikkapa 3 yksikköä sisältävässä trimeerissä on 2 samanlaista yksikköä ja 1 erilainen, proteiini on heterotrimeeri. Jos trimeerin yksiköt ovat samanlaisia, se on homotrimeeri.[3]
Lisäksi useiden yksikköjen voidaan ajatella tuottavan 2:n tai useamman yksikön yksikköjä, joita sanotaan protomeereiksi. Esimerkiksi hemoglobiini A on heterotetrameeri, sillä siinä on 2 α-yksikköä ja 2 β-yksikköä – α- ja β-yksiköt ovat keskenään erilaisia ja niitä on 4. Hemoglobiinia voidaan myös sanoa diprotomeeriksi, sillä sen voidaan ajatella koostuvan 2:sta αβ-protomeeristä.[3]
| 1 = monomeeri / proteiiniyksikkö / alayksikkö | 7 = heptameeri / 7-meeri | 13 = tridekameeri / 13-meeri |
| 2 = dimeeri / 2-meeri | 8 = oktameeri / 8-meeri | 14 = tetradekameeri / 14-meeri |
| 3 = trimeeri / 3-meeri | 9 = nonameeri / 9-meeri | 15 = pentadekameeri / 15-meeri |
| 4 = tetrameeri / 4-meeri | 10 = dekameeri / 10-meeri | 16 = heksadekameeri / 16-meeri |
| 5 = pentameeri / 5-meeri | 11 = undekameeri /11-meeri | 17 = heptadekameeri / 17-meeri |
| 6 = heksameeri / 6-meeri | 12 = dodekameeri / 12-meeri | jne. |
 Homodimeeri. 2 samanlaista proteiiniyksikköä (korostettu eri värein). Galaktoosi-1-fosfaattiuridyylitransferaasi, PDB: 1GUP.
Homodimeeri. 2 samanlaista proteiiniyksikköä (korostettu eri värein). Galaktoosi-1-fosfaattiuridyylitransferaasi, PDB: 1GUP.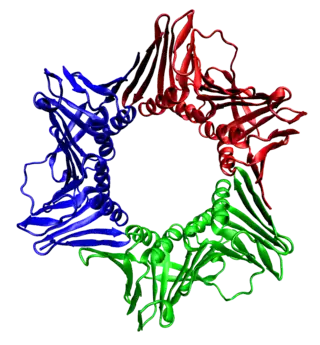 Homotrimeeri. 3 samanlaista proteiiniyksikköä (korostettu eri värein). Proliferoivan solun tuma-antigeeni, PDB: 1AXC.
Homotrimeeri. 3 samanlaista proteiiniyksikköä (korostettu eri värein). Proliferoivan solun tuma-antigeeni, PDB: 1AXC.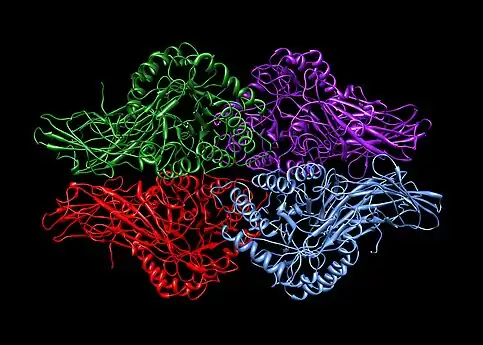 Homotetrameeri. 4 samanlaista proteiiniyksikköä (korostettu eri värein). Beetaglukuronidaasi. PDB: 1BHG.
Homotetrameeri. 4 samanlaista proteiiniyksikköä (korostettu eri värein). Beetaglukuronidaasi. PDB: 1BHG. Heterotetrameeri. 2 erilaista proteiiniyksikköä (punainen ja sininen), joita on 4. Hemoglobiini A, PDB: 1GZX.
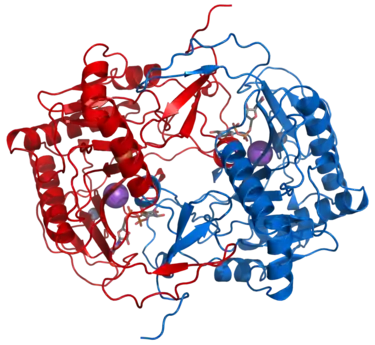
Heterotetrameeri. 2 erilaista proteiiniyksikköä (punainen ja sininen), joita on 4. Hemoglobiini A, PDB: 1GZX.
Symmetria
Kvaternäärirakenteita voidaan kuvata myös niiden symmetrian mukaan. Rakenteet voivat esimerkiksi olla kiertosymmetrisiä (eng. rotational symmetry), kierresymmetrisiä (eng. helical symmetry) tai ikosaedrisia. Kiertosymmetriset proteiinit voivat olla syklisiä tai diheraalisia. Syklisessä symmetriassa yksiköt ovat samassa tasossa ja tuottavat kehämäisen rakenteen. Hemoglobiini A on tästä esimerkki. Dihedraalisessa symmetriassa vähintään 2 yksikköä muodostaa tason, jonka päälle muodostuu toisia samanlaisia tasoja tasojen läpi kulkevan symmetria-akselin suuntaisesti. Tasot voivat olla kiertyneitä suhteessa toisiinsa. Ikosaedrinen symmetria on tyypillistä virusten kapsideissa (esimerkki: poliovirus), mutta jotkin kapsidit ovat kierresymmetrisiä (esimerkki: tupakan mosaiikkivirus).[2]
Rakenteen etuja
Evoluutio on johtanut monissa tapauksissa kvaternäärirakenteisten proteiinien muodostumiseen yhtenäisten suurien tai pienempien proteiinien sijaan.[4] Näihin verrattuna kvaternäärirakenteissa voi tapauskohtaisesti olla muun muassa seuraavia etuja:
- ne mahdollistavat monimutkaisten, symmetristen ja isojen rakenteiden, kuten kuiturakenteiden, renkaiden ja virusten onttojen kapsidien muodostumisen, joiden tuotto olisi muuten hankalaa.[4]
- ne mahdollistavat yksiköiden niin sanotut ko-operatiiviset vuorovaikutukset allosteerisesti. Yhden yksikön konformaatio voi muuntua esimerkiksi jonkin aineen sitoutuessa siihen. Muutos edistää muidenkin yksiköiden konformaatioiden muutoksia, jolloin esimerkiksi proteiinin entsyymitoiminta tehostuu.[4] Hemoglobiini A on tästä esimerkki – kvaternäärirakenne on sen toiminnan kannalta välttämätön. Hapen (O2) liittyessä keuhkoissa yhteen muuten happea sitomattoman niin sanottuun deoksihemoglobiinin yksiköistä, voi yksikkö muuntaa konformaatiotaan happea vahvasti eli suurella affiniteetilla sitovaan konformaatioon. Muutos saa muutkin yksiköt muuntumaan pian suuren affiniteetin konformaatioihin, jolloin hemoglobiinin kyky sitoa happea keuhkoissa on suuri. Muualla kehon verenkierrossa happipitoisuudet ovat matalat ja happea vapautuu niissä helpommin. Happien alkaessa irrota konformaatiot palaavat pienen affiniteetin konformaatioon, jolloin happi vapautuu tehokkaasti kudoksissa.[5]
- ne suojaavat denaturaatiolta. Suurissa proteiineissa on enemmän niiden rakennetta vakauttavia vuorovaikutuksia.[4]
- translaation aikana tapahtuu virheitä. Suhteessa kvaternäärisiin proteiineihin, suurten yhtenäisten proteiinien valmistus kerralla lisää virheiden riskiä ja siten proteiineina toimimattomien peptidiketjujen muodostumista.[4]
- kvaternääristen proteiinien geenit ovat lyhyitä suhteessa saman kokoluokan suuriin proteiineihin. Tällä on merkitystä eritoten virusten kohdalla, jotka ovat kooltaan hyvin pieniä ja siksi niiden geenienkin tulisi olla mahdollisimman pieniä, jotta ne mahtuvat virusten kapsideihin.[4]
- niiden tuottoa voidaan ohjata tarpeen mukaan. Esimerkiksi aktiinimonomeerit tuottavat vaihtelevan pituisia säikeitä, joiden pituus muuttuu eritoten mitoosin aikana ja kvaternäärirakenteiden käyttö mahdollistaa tällaiset muutokset.[4]
Lähteet
- DL Nelson et al: Lehninger principles of biochemistry. W.H. Freeman, 2008. ISBN 9780716771081.
Viitteet
- Nelson, s. 123–125
- Nelson, s. 135–140
- E Buxbaum: Fundamentals of protein structure and function, s. 27, 108. Springer, 2007. ISBN 9780387684802.
- DS Goodsell, AJ Olson: Structural symmetry and protein function. Annual Review of Biophysics and Biomolecular Structure, 2000, 29. vsk, s. 105–153. PubMed:10940245. doi:10.1146/annurev.biophys.29.1.105. ISSN 1056-8700. Artikkelin verkkoversio. (Arkistoitu – Internet Archive)
- Nelson, s. 648–649