Anhydridit
Anhydridit ovat kemiallisia yhdisteitä, joiden voidaan ajatella muodostuvan H2O-molekyylin poistamisella. Esimerkiksi kaksi etikkahappomolekyyliä (engl. acetic acid) muodostavat etikkahappoanhydridin (engl. acetic anhydride):
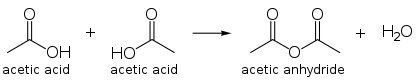
Lisäksi esimerkiksi natriumoksidi on natriumhydroksidin anhydridi, koska
- 2 NaOH = Na2O + H2O
ja rikkitrioksidi on rikkihapon anhydridi:
- H2SO4 = SO3 + H2O
Anhydridit orgaanisessa kemiassa

Anhydridit orgaanisessa kemiassa ovat lähinnä happoanhydridejä, eli karboksyylihapon johdannaisia. Ne muodostavat alkoholien kanssa estereitä nukleofiilisen substituutioreaktion SN2 kautta, jossa alkoholin hydroksyyliryhmän happiatomin yksinäinen elektronipari hyökkää karbonyyliryhmän C-O hylkivälle π*-orbitaalille.
Happoanhydridit ovat tyypillisesti reaktiivisempia, eli nukleofiilit reagoivat niiden kanssa paremmin kuin muut karboksyylijohdannaiset, kuten amidit tai esterit. Tämä on seurausta hapen elektroneita vetävästä ominaisuudesta. Se vetää elektroneita pois karbonyylistä kasvattaen positiivista osittaisvarausta hiilellä ja siten kasvattaen sähköstaattista vetovoimaa nukleofiilin ja karbonyylin välillä. Happi myös luovuttaa elektroneita karbonyyliin, mutta sen elektronitiheyttä vetävä vaikutus on vahvempi tässä tapauksessa.
Veden kanssa reagoidessaan happoanhydridit muodostavat niitä vastaavia karboksyylihappoja. Esimerkiksi etikkahappoanhydridi muodostaa etikkahappoa. Anhydridit ovatkin tehokkaita veden sitojia, eli kuivaavia reagenssejä.
Etikkahappoanhydridiä käytetään myös aspiriinin valmistuksessa. Se lisää asetyyliryhmän salisyylihappoon, josta tuotteena on asetyylisalisyylihappo, eli aspiriini. Anhydridin käyttö on tehokkaampaa, koska etikkahapon käyttö tuottaa vettä, joka voi hydrolysoida tuotteen. Anhydridistä valmistetaan asyliumioni (engl. acylium ion) esimerkiksi Friedel–Crafts-asyloinnilla. Asyliumioni jatkaa reaktiota, johtaen asetyyliryhmän lisäykseen. Asyliumionin valmistus anhydridistä alla:

Epäorgaanisia happoanhydridejä
Yleiskaavaltaan HxEOy tyypillisen epäorgaanisen happihapon täysin dehydratoitunut yhdiste on EOy-x/2 tai E2O2*y-x.
| Happo | Anhydridioksidi |
|---|---|
| perkloorihappo (HClO4) | diklooriheptoksidi (Cl2O7) |
| kloorihappo (HClO3) | diklooripentoksidi (Cl2O5) |
| rikkihappo (H2SO4) & dirikkihappo (H2S2O7) | rikkitrioksidi (SO3) |
| rikkihapoke (H2SO3) & dirikkihapoke (H2S2O5) | rikkidioksidi (SO2) |
| typpihappo (HNO3) | dityppipentoksidi (N2O5) |
| typpihapoke (HNO2) | dityppitrioksidi (N2O3) |
| fosforihappo (H3PO4) & pyrofosforihappo (H4P2O7) | fosforipentoksidi (P2O5) |
| fosforihapoke (H3PO3) & difosforihapoke (H4P2O5) | fosforitrioksidi (P2O3) |
| hiilihappo (H2CO3) | hiilidioksidi (CO2) |
| boorihappo (H3BO3) | boorioksidi (B2O3) |
Anhydridit biologisissa järjestelmissä
Suurienergiaiset biokemialliset molekyylit, kuten ATP ovat anhydridejä.
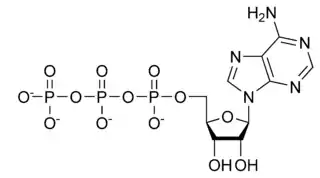 ATP sisältää suurienergisiä fosfoanhydridisidoksia fosfaattiryhmien välillä.
ATP sisältää suurienergisiä fosfoanhydridisidoksia fosfaattiryhmien välillä.
Lähteet
- Clayden, Greeves, Warren ja Wothers: Organic Chemistry. Oxford University Press, 2004. ISBN 0-19-850346-6.