Fosforyylikloridi
Fosforyylikloridi eli fosforioksikloridi (POCl3) on myrkyllinen kloorin, hapen ja fosforin muodostama molekyyliyhdiste. Ainetta käytetään orgaanisessa kemiallisessa synteesissä fosfaattiestereiden ja syklisten yhdisteiden valmistamisessa.
| Fosforyylikloridi | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | 10025-87-3 |
| Ominaisuudet | |
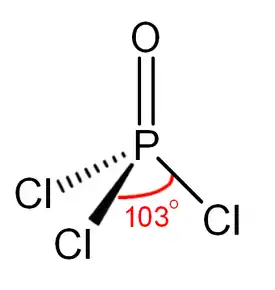
| Molekyylikaava | POCl3 |
| Moolimassa | 153,32 g/mol |
| Ulkomuoto | Väritön neste |
| Sulamispiste | 1,25 °C [1] |
| Kiehumispiste | 105,8 °C [1] |
| Tiheys | 1,645 g/cm3 [1] |
| Liukoisuus veteen | Reagoi veden kanssa [1] |
Ominaisuudet
Huoneenlämpötilassa fosforyylikloridi on väritöntä nestettä, joka savuaa ja jolla on helposti tunnistettava pistävä haju. Aine on erittäin reaktiivinen ja reagoi kiivaasti niin veden kuin erilaisten orgaanisten yhdisteiden kanssa. Fosforyylikloridin kuumentaminen hajottaa sen suolahapoksi ja fosforin oksideiksi.[1]
Valmistus
Fosforyylikloridia voidaan valmistaa monella eri tavalla. Teollisesti ainetta valmistetaan joko alkuaineistaan tai klooraamalla fosforitrikloridia.[2]
- P4 + 2 O2 + 6 Cl2 → 4 POCl3
- 2 PCl3 + O2 → 2 POCl3
Muita tapoja valmistaa fosforyylikloridia ovat fosforitrikloridin hapettaminen kaliumkloraatilla ja fosforipentakloridin ja rikkidioksidin reaktio, jolloin syntyy myös tionyylikloridia. Fosforyylikloridia syntyy myös, kun fosforipentakloridi reagoi pienen vesimäärän kanssa. Tässä reaktiossa on ongelmana fosforyylikloridin edelleen reagoiminen veden kanssa, jolloin syntyy fosforihappoa ja suolahappoa.[2]
- 3 PCl3 + KClO3 → 3 POCl3 + KCl
- PCl5 + SO2 → POCl3 + SOCl2
- PCl5 + H2O → POCl3 + 2 HCl
Reaktioita
Fosforyylikloridia käytetään erityisesti fosfaattiestereiden synteesissä. Fosforyylikloridin reagoidessa alkoholin tai fenolin kanssa syntyy kaksi fosforodikloridaattivälituotetta, joiden jälkeen syntyy toivottu esteri. Reaktioista nopein on ensimmäisen välituotteen muodostuminen ja hitain lopullisen tuotteen eli esterin muodostuminen.[3]
- POCl3 + ROH → ROP(O)Cl2 → (RO2)P(O)Cl → (RO)3PO
Fosforyylikloridia käytetään myös rengasrakenteisten yhdisteiden synteesissä, joissa se on osoittautunut tehokkaammaksi kuin fosforipentoksidi.[4]
Turvallisuus
Fosforyylikloridi on myrkyllistä ja suurille annoksille altistuminen voi johtaa jopa kuolemaan. Aineen hengittäminen voi aiheuttaa hengitysvaikeuksia, yskää, pahoinvointia, johon liittyy oksentamista, ja tajunnan menetyksen. Aineen nieleminen aiheuttaa vatsakipuja sekä kouristuksia ja tajuttomuuden. Fosforyylikloridi voi syövyttää joutuessaan iholle tai silmiin.[1]
Lähteet
- Fosforyylikloridin kansainvälinen kemikaalikortti Viitattu 9.4.2009
- Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: Inorganic chemistry, s. 725. Academic Press, 2001. ISBN 978-0-12-352651-9. Kirja Googlen teoshaussa (viitattu 9.4.2009). (englanniksi)
- Peter G. M. Wuts, Theodora W. Greene: Greene's protective groups in organic synthesis, s. 939. John Wiley and Sons, 2006. ISBN 978-0-471-69754-1. Kirja Googlen teoshaussa (viitattu 9.4.2009). (englanniksi)
- Alan R. Katritzky, István Hermecz, Géza Keresztúri, Lelle Vasvári-Debreczy: Advances in Heterocyclic Chemistry, s. 163. Academic Press, 1992. ISBN 9780120207541. Kirja Googlen teoshaussa (viitattu 9.4.2009). (englanniksi)