Fosforihapoke
Fosforihapoke eli fosfonihappo (H3PO3) on yksi fosforin happihapoista. Sitä käytetään pääasiassa muiden yhdisteiden valmistukseen.
| Fosforihapoke | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | 13598-36-2 |
| Ominaisuudet | |
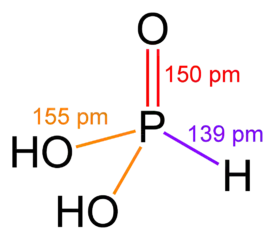
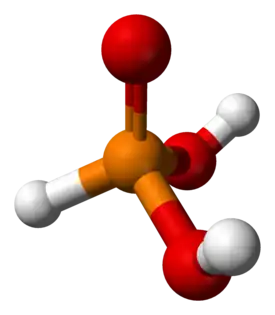
| Molekyylikaava | H3PO3 |
| Moolimassa | 81,994 |
| Ulkomuoto | Värittömiä kiteitä |
| Sulamispiste | 73,6 °C[1] |
| Tiheys | 1,65 g/cm3[2] |
| Liukoisuus veteen | 310 g/100 ml |
Ominaisuudet
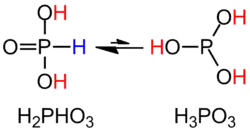
Fosforihapoke on diproottinen happo, ja se muodostaa protoneja luovuttaessaan vetyfosfiitti- ja fosfiitti-ioneja. Ensimmäisen protonin luovutukselle pKa-arvo on 1,5, ja se on vahvempi happo kuin fosforihappo. Toiselle protonin luovuttamiselle pKa-arvo on 6,7. Fosforihapokkeella on kaksi tautomeerista muotoa. Niistä toisessa vetyatomit ovat sitoutuneet happiatomeihin ja toisessa yksi vetyatomeista on sitoutunut fosforiatomiin ja kaksi happiatomeihin. Tämä muoto on vallitseva.[1][2][3]
Fosforihapoke on voimakas pelkistin, ja ilma hapettaa sen hitaasti fosforihapoksi. Se kykenee pelkistämään muun muassa jalometallien kationit vapaiksi metalleiksi. Reaktiot eivät kuitenkaan tapahdu yhtä nopeasti ja voimakkaasti kuin hypofosforihapokkeen reaktiot. Kuumennettaessa yli 180 °C yhdiste hajoaa disproportioituen fosfiiniksi ja fosforihapoksi.[1][2][3]
- 4 H3PO3 → 3 H3PO4 + PH3
Valmistus ja käyttö
Ensimmäisen kerran fosforihapoketta valmisti Georges-Louis Le Sage vuonna 1777 hapettamalla valkoista fosforia kostealla ilmalla. Nykyään yhdistettä valmistetaan teollisesti liuottamalla fosforitrioksidia veteen tai vielä yleisemmin johtamalla fosforitrikloridia vesihöyryyn 180–190 °C lämpötilassa. Ylimäärä vettä ja reaktion sivutuotteena muodostuva suolahappo haihtuvat pois tässä lämpötilassa. Reaktorin jäähtyessä fosforihapoke kiteytyy ja voidaan erottaa.[1][2][3]
- PCl3 + 3 H2O → H3PO3 + 3 HCl
Fosforihapoketta voidaan tuottaa myös käsittelemällä fosfiittisuoloja vahvalla hapolla, kuten rikkihapolla, jolloin fosforihapoke vapautuu.[1]
- CaHPO3 + H2SO4 → H3PO3 + CaSO4
Fosforihapoketta käytetään pelkistimenä ja valmistettaessa fosfiittiestereitä, joita käytetään muun muassa veden käsittelyssä, tuholaismyrkkyinä ja muovien stabilointiaineina. Muovien stabilointiin käytetään myös muun muassa lyijyfosfiittia, jota valmistetaan fosforihapokkeesta.[2][3]
Lähteet
- Darrell C. Fee, David R. Gard & Chen-Hsyong Yang: Phosphorus Compounds, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2006 Viitattu 26.06.2012
- Gerhard Bettermann, Werner Krause, Gerhard Riess & Thomas Hofmann: Phosphorus Compounds, Inorganic, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2000 Viitattu 26.06.2012
- Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: Inorganic chemistry, s. 717. Academic Press, 2001. ISBN 978-0-12-352651-9. Kirja Googlen teoshaussa (viitattu 26.06.2012). (englanniksi)