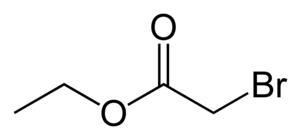
Etyylibromiasetaatti
Etyylibromiasetaatti (C4H7BrO2) on etanolin ja bromietikkahapon esteri. Yhdistettä käytetään orgaanisessa synteesissä ja kyynelkaasuna.
| Etyylibromiasetaatti | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | |
| IUPAC-nimi | Etyyli-2-bromiasetaatti |
| SMILES | CCOC(=O)CBr [1] |
| Ominaisuudet | |
| Kemiallinen kaava | C4H7BrO2 |
| Moolimassa | 166,996 g/mol |
| Tiheys | 1,506 g/cm3[2] g/cm³ |
| Kiehumispiste | 168–169 °C[2] |
Ominaisuudet ja käyttö
Huoneenlämpötilassa etyylibromiasetaatti on kirkasta tai kellertävää nestettä, joka höyrystyy melko helposti. Yhdiste liukenee huonosti veteen ja hajoaa hitaasti veden vaikutuksesta. Paremmin etyylibromiasetaatti liukenee etanoliin tai dietyylieetteriin.[2] Yhdistettä voidaan valmistaa etikkahaposta kahdessa vaiheessa. Ensimmäisessä vaiheessa etikkahappo bromataan, jolloin muodostuu bromietikkahappoa. Bromietikkahappo esteröidään etanolin kanssa väkevän rikkihapon toimiessa katalyyttinä, jolloin tuotteeksi muodostuu etyylibromiasetaattia.[3]
Etyylibromiasetaatti on myrkyllistä ja ärsyttävää[2], minkä vuoksi sitä on käytetty kyynelkaasuna. ensimmäisessä maailmansodassa ranskalaiset käyttivät etyylibromiasetaattia taistelukaasuna saksalaisia vastaan.[4][5]
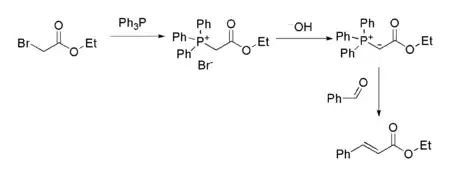
Etyylibromiasetaattia käytetään eräiden lääkeaineiden, kuten karbokromeenin, mibefradiilin ja sulindaakin valmistamiseen.[6] Orgaanisessa synteesissä etyylibromiasetaattia käytetään erityisesti niin kutsutussa Reformatski-reaktiossa, jossa etyylibromiasetaatti reagoi sinkkimetallin kanssa muodostaen sinkkienolaatin, joka voi reagoida karbonyyliyhdisteiden kanssa muodostaen β-hydroksiestereitä[7]. Etyylibromiasetaatti reagoi myös trifenyylifosfiinin kanssa, jolloin muodostuvaa tuotetta käytetään Wittig-reaktioissa esimerkiksi etyylikinnamaatin valmistamiseen.[8]
Lähteet
- Ethyl bromoacetate – Substance summary NCBI. Viitattu 11. joulukuuta 2012.
- Alén, Raimo: Kokoelma orgaanisia yhdisteitä: Ominaisuudet ja käyttökohteet, s. 356. Helsinki: Consalen Consulting, 2009. ISBN 978-952-92-5627-3.
- Samuel Natelson &Sidney Gottfried: Ethyl bromoacetate. Organic Syntheses, 1955, 3. vsk, nro 381. Artikkelin verkkoversio. Viitattu 11.12.2012. (englanniksi)
- DW Criswell, FL McClure, R Schaefer & KR Brower: War gases as olfactory probes. Science, 1980, 210. vsk, nro 4468, s. 425-426. Artikkelin verkkoversio. Viitattu 11.12.2012. (englanniksi)
- Anil K De: Environmental Chemistry, s. 114. New Age International, 2003. ISBN 978-81-224-2617-5. Kirja Googlen teoshaussa (viitattu 11.12.2012). (englanniksi)
- David Ioffe & Ron Frim: Bromine, Organic Compounds, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2011. Viitattu 11.12.2012
- Jonathan Clayden, Nick Greeves, Stuart Warren, Peter Wothers: Organic Chemistry, s. 709. Oxford University Press, 2008. ISBN 978-0-19-850346-0. (englanniksi)
- P.S. Kalsi: Stereohemistry, s. 511. New Age International, 2005. ISBN 978-81-224-2356-3. Kirja Googlen teoshaussa (viitattu 11.12.2012). (englanniksi)