Natriumvetyfosfaatti
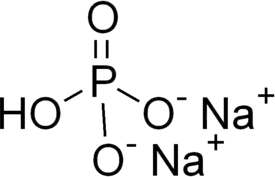
Natriumvetyfosfaatti eli dinatriumfosfaatti (Na2HPO4) on natrium- ja monovetyfosfaatti-ioneista muodostuva epäorgaaninen ioniyhdiste. Yhdistettä käytetään muun muassa elintarvikkeiden lisäaineena, puskuriliuoksissa ja muiden yhdisteiden valmistuksessa.
| Natriumvetyfosfaatti | |
|---|---|
 |
|
| Tunnisteet | |
| CAS-numero | 7558-79-4 |
| Ominaisuudet | |
| Molekyylikaava | Na2HPO4 |
| Moolimassa | 141,958 |
| Ulkomuoto | Väritön tai valkoinen kiteinen aine[1] |
| Sulamispiste | 300 °C (hajoaa)[1] |
| Tiheys | 1,7 g/cm3 |
| Liukoisuus veteen | Liukenee veteen |
Rakenne ja ominaisuudet
Huoneenlämpötilassa natriumvetyfosfaatti on kiinteää kiteistä ainetta. Se liukenee hyvin veteen ja on hygroskooppista. Alkeiskopiltaan natriumvetyfosfaatti on monokliininen ja natriumionit sijaitsevat oktaedrisissä ja tetraedrisissä välisijoissa kidehilassa. Kidevedettömän yhdisteen lisäksi tunnetaan useita kidevedellisiä muotoja. Näitä ovat muun muassa dihydraatti (Na2HPO4·2H2O), heptahydraatti (Na2HPO4·7H2O), oktahydraatti (Na2HPO4·8H2O) ja dodekahydraatti (Na2HPO4·12H2O). Kidevesi poistuu natriumvetyfosfaatin rakenteesta vaiheittain, kun sitä kuumennetaan 35–100 °C:n lämpötilaan. Enemmän kuumennettaessa se hajoaa muodostaen natriumpyrofosfaattia.[1][2][3][4]
Valmistus ja käyttö
Natriumvetyfosfaattia valmistetaan neutraloimalla fosforihappoa stoikiometrisellä määrällä natriumkarbonaatilla tai natriumhydroksidilla.[1][5] Toinen tapa on kalsiumvetyfosfaatin ja natriumkarbonaatin tai natriumsulfaatin välinen reaktio, jolloin saostuu niukkaliukoista kalsiumkarbonaattia tai kalsiumsulfaattia ja natriumvetyfosfaatti jää liuokseen.[1][3]
- H3PO4 + Na2CO3 → Na2HPO4 + H2O + CO2
- CaHPO4 + Na2SO4 → Na2HPO4 + CaSO4
Suurin yksittäinen käyttökohde natriumvetyfosfaatille on toimiminen emulgaattorina juustonvalmistuksen yhteydessä. Yhdistettä käytetään elintarvikkeissa, kuten juustoissa, leivonnaisissa ja lihavalmisteissa, happamuudensäätöaineena, hapettumisenestoaineena ja sulatesuolana. Natriumvetyfosfaatin E-koodi yhdessä natriumfosfaatin ja natriumdivetyfosfaatin kanssa on E 339. Muita käyttökohteita ovat puskuriliuoksena toimiminen yhdessä natriumdivetyfosfaatin kanssa, tekstiilien palonestokäsittelyissä, silkkipainannassa, emalien ja lasitteiden valmistuksessa ja vedenpehmennyksessä muun muassa lämmitysvesikattiloissa.[1][2][3][4][5][6][7]
Lähteet
- E. M. Karamäki: Epäorgaaniset kemikaalit, s. 347. Kustannusliike Tietoteos, 1983. ISBN 951-9035-61-3.
- David R. Gard: Phosphoric Acids and Phosphates, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2005. Viitattu 21.07.2013
- Klaus Schrödter, Gerhard Bettermann, Thomas Staffel, Friedrich Wahl, Thomas Klein & Thomas Hoffmann: Phosphoric Acid and Phosphates, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2008. Viitattu 21.07.2013
- Thomas Scott, Mary Eagleson: Concise encyclopedia chemistry, s. 1000. Walter de Gruyter, 1994. ISBN 978-3110114515. Kirja Googlen teoshaussa (viitattu 21.07.2013). (englanniksi)
- Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: Inorganic chemistry, s. 722. Academic Press, 2001. ISBN 978-0-12-352651-9. Kirja Googlen teoshaussa (viitattu 21.07.2013). (englanniksi)
- E-koodiavain 2011. Evira. Arkistoitu 29.10.2013. Viitattu 21.7.2013.
- Lisäaineopas 2009. Evira. Arkistoitu 4.7.2013. Viitattu 21.7.2013.