Dimedoni
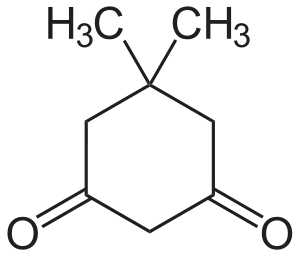
Dimedoni (C8H12O2) on rengasrakenteinen diketoneihin kuuluva orgaaninen yhdiste. Yhdistettä voidaan käyttää reagenssina analyyttisessä kemiassa ja orgaanisen kemian synteeseissä.
| Dimedoni | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | |
| IUPAC-nimi | 5,5-dimetyylisykloheksaani-1,3-dioni |
| SMILES | CC1(CC(=O)CC(=O)C1)C[1] |
| Ominaisuudet | |
| Kemiallinen kaava | C8H12O2 |
| Moolimassa | 140,176 g/mol |
| Sulamispiste | 148-150 °C (hajoaa)[2] |
| Liukoisuus | 4,16 g/l (25 °C)[2] |
Ominaisuudet

Dimedoni on huoneenlämpötilassa valkoista tai keltaista kiteistä ainetta. Yhdiste liukenee hieman veteen ja liukoisuus on suurempi lämpimään kuin viileään veteen. Lisäksi se liukenee moniin orgaanisiin liuottimiin kuten etanoliin, etikkahappoon, kloroformiin ja bentseeniin. Dimedonin vesiliuoksest hapettuvat hitaasti ilman hapen ja valon vaikutuksesta. Dimedoni on heikko happo ja sen pKa-arvo on 5,15.[2][3]

Muiden 1,3-dikarbonyyliyhdisteiden tavoin dimedonilla esiintyy keto-enolitautomeriaa ja enolimuotoa stabilisoi resonanssi. Kloroformiliuoksessa noin 66 % dimedonimolekyyleistä esiintyy diketonina ja noin 33 % enolina.[4] Kloroformi liuoksessa yhdiste esiintyy osittain dimeereinä, jotka ovat linkittyneet toisiinsa vetysidoksin[5]. Kiinteänä yhdiste esiintyy enolina niin kutsutussa kirjekuorikonformaatiossa ja molekyylit ovat linkittyneet toisiinsa vetysidoksin ketjuksi[6].
Valmistus ja käyttö
Dimedonia valmistetaan dietyylimalonaatin ja mesityylioksidin välisellä reaktiolla. Reaktion ensimmäisessä vaiheessa tapahtuu Michael-additio dietyylimalonaatin enolaatin ja mesityylioksidin olefiinisen kaksoissidoksen välillä ja muodostuva välivaihe syklisoituu Claisen-kondensaatiolla muodostaen etyyli-5,5-dimetyyli-1,3-sykloheksaanidioni-4-karboksylaattia, joka hydrolysoidaan emäksisissä olosuhteissa 5,5-dimetyyli-1,3-sykloheksaanidioni-4-karboksyylihapoksi. Tästä yhdisteestä eliminoituu hiilidioksidi happokäsittelyn seurauksena ja muodostuu dimedonia.[2][3][7][8][9]
Dimedonia käytetään analyyttisessä kemiassa tunnistamaan aldehydejä ketoneista. Aldehydien kanssa dimedoni reagoi muodostaen liukenemattoman kiteisen yhdisteen, jota kutsutaan dimetoniksi. Ketonit eivät reagoi dimedonin kanssa samoin. Dimedonista ja ketonista muodostuva dimetoni voidaan muuttaa happokäsittelyn avulla heterosykliseksi dimetonianhydridiksi.[2][10] Orgaanisissa synteeseissä dimedonia voidaan käyttää suojaamaan amiineja ja heterosyklisten yhdisteiden synteeseissä. Lisäksi yhdistettä voidaan käyttää syanidi-ionien spektrofotometriseen määritykseen.[11] Dimedoni läpäisee solukalvon ja sen enolimuoto reagoi hapettuneiden proteiinien sulfeenihapporyhmien kanssa muodostaen konjugaatin. Näitä konjugaatteja voidaan käyttää proteiinien merkitsemiseen reversiibelisti, joko ennen tai jälkeen solujen hajottamisen. Dimedoniin voidaan myös liittää fluoresoiva ryhmä, jolloin dimedonin kanssa konjugaatin muodostaneet proteiinit voidaan tunnistaa fluoresenssin perusteella.[12]
Lähteet
- Dimedone – Substance summary PubChem. NCBI. Viitattu 23.8.2015.
- Susan Budavari (päätoim.): Merck Index, s. 548-549. 12th Edition. Merck & Co., 1996. ISBN 0911910-12-3. (englanniksi)
- Thomas Scott, Mary Eagleson: Concise encyclopedia chemistry, s. 325. Walter de Gruyter, 1994. ISBN 978-3110114515. Kirja Googlen teoshaussa (viitattu 23.8.2015). (englanniksi)
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organic Chemistry, s. 457. Oxford University Press, 2012. ISBN 978-0-19-927029-3. (englanniksi)
- Penny Chaloner: Organic chemistry, s. 786. CRC Press, 2014. ISBN 9781482206906. Kirja Googlen teoshaussa (viitattu 23.8.2015). (englanniksi)
- M. Bolte & M. Scholtyssik: Dimedone at 133K. Acta Crystallographica Section C, 1997, 53. vsk, nro 10, s. IUC9700013. Artikkelin verkkoversio. Viitattu 23.8.2015. (englanniksi)
- Peter Pollak & Gérard Romeder: Malonic Acid and Derivatives, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2000. Viitattu 23.8.2015
- Harald Strittmatter, Stefan Hildbrand & Peter Pollak: Malonic Acid and Derivatives, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2007. Viitattu 23.8.2015
- Adam Jacobs: Understanding Organic Reaction Mechanisms, s. 242-244. Cambridge University Press, 1997. ISBN 978-0521467766. Kirja Googlen teoshaussa (viitattu 23.8.2015). (englanniksi)
- Steven Pedersen,Arlyn Myers: Understanding the Principles of Organic Chemistry, s. 332. Cengage Learning, 2010. ISBN 978-0495829935. Kirja Googlen teoshaussa (viitattu 23.8.2015). (englanniksi)
- Alan Townshend: Dictionary of analytical reagents, s. 415. CRC Press, 1993. ISBN 9780412351501. Kirja Googlen teoshaussa (viitattu 23.8.2015). (englanniksi)
- Kendra K. Bence: Protein Tyrosine Phosphatase Control of Metabolism, s. 11-12. Springer, 2013. ISBN 978-1-4614-7855-3. Kirja Googlen teoshaussa (viitattu 23.8.2015). (englanniksi)