Diepoksibutaani
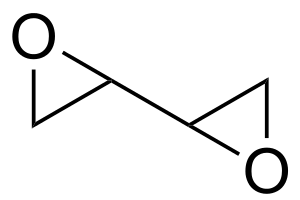
Diepoksibutaani eli butadieenidiepoksidi tai erytritolianhydridi (C4H6O2) on orgaaninen yhdiste, joka sisältää kaksi epoksidiryhmää. Yhdistettä käytetään polymeerien valmistuksessa ja orgaanisessa synteesissä.
| Diepoksibutaani | |
|---|---|
 |
|
| Tunnisteet | |
| CAS-numero | |
| IUPAC-nimi | 2,2’-bioksiraani |
| SMILES | C1C(O1)C2CO2[1] |
| Ominaisuudet | |
| Kemiallinen kaava | C4H6O2 |
| Moolimassa | 86,088 g/mol |
| Tiheys | 1,113[2] g/cm³ |
| Sulamispiste | 2 °C[2] |
| Kiehumispiste | 144 °C [2] |
| Liukoisuus | Sekoittuu veteen |
|
|
|
Ominaisuudet
Huoneenlämpötilassa diepoksibutaani on väritöntä nestettä. Yhdiste liukenee hyvin veteen, mutta hydrolysoituu vedessä muodostaen erytritolia. Diepoksibutaani on optisesti aktiivinen yhdiste ja siitä tunnetaan (+)- ja (-)-isomeerien lisäksi optisesti tehoton mesoyhdiste.[3][4]
Valmistus ja käyttö
Diepoksibutaanin raseemista seosta voidaan valmistaa usealla tavalla, muun muassa lähtemällä erytrityylikloorihydriinistä tai kuumentamalla emäksisissä olosuhteissa 1,4-dikloori-2,3-butaanidiolia tai 1,4-dibromi-2-buteenia. Yhdisteen mesomuotoa voidaan syntetisoida 1,4-dihydroksi-2-buteenista tai 3,4-epoksi-1-buteenista.[3]
Diepoksibutaania käytetään tutkimuskemikaalina ja valmistettaessa muita yhdisteitä kuten erytritolia ja eräitä lääkeaineita. Polymeeriteollisuudessa sitä käytetään muovien kovettamiseen ja keinokuitujen ristisitomiseen. Diepoksibutaania voidaan käyttää myös mikrobien kasvua estävänä aineena.[3][4][5]
Metaboliittina ja myrkyllisyys
Ihmiselimistössä diepoksibutaania muodostuu maksassa 1,3-butadieenistä. Yhdiste hapettuu ensin monoepoksidiksi ja tämän jälkeen diepoksibutaaniksi.[3][4][5] Syöpälääkkeenä käytettävä treosulfaani on aihiolääke, joka metaboloituu ihmiselimistössä ei-entsymaattisesti diepoksibutaaniksi, joka toimii varsinaisena syöpäsolujen DNA:ta alkyloivana yhdisteenä[6].
Rottakokeissa diepoksibutaanin on todettu aiheuttavan kasvaimia ja yhdiste on todennäköisesti karsinogeeninen myös ihmisille.[5][4] Yhdiste ärsyttää ihoa ja hengitysteitä.[5]
Lähteet
- Erythritol anhydride – Substance summary PubChem. NCBI. Viitattu 12.2.2014.
- William M. Haynes, David R. Lide, Thomas J. Bruno: CRC Handbook of Chemistry and Physics, s. 3.48. 39th Edition. CRC Press, 2012. ISBN 978-1439880494. Kirja Googlen teoshaussa (viitattu 12.2.2014). (englanniksi)
- Susan Budavari (päätoim.): Merck Index, s. 624. 12th Edition. Merck & Co., 1996. ISBN 0911910-12-3. (englanniksi)
- Diepoxybutane (PDF) (s. 151) 12th Report on Carcinogens (RoC). 10.6.2011. Viitattu 12.2.2014.
- Nick H. Proctor, Gloria J. Hathaway, James P. Hughes: Proctor and Hughes' Chemical hazards of the workplace, s. 244. Wiley-IEEE, 2004. ISBN 978-0-471-26883-3. Kirja Googlen teoshaussa (viitattu 12.2.2014). (englanniksi)
- David E. Thurston: Chemistry and pharmacology of anticancer drugs, s. 57. CRC Press, 2006. ISBN 9780849392191. Kirja Googlen teoshaussa (viitattu 12.2.2014). (englanniksi)



