Booritrifluoridi
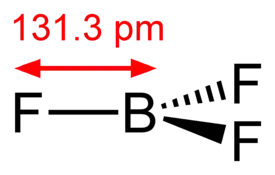
Booritrifluoridi eli trifluoriboraani (BF3) on boorin ja fluorin muodostama molekyyliyhdiste. Aine on Lewis-happo ja sitä käytetään muun muassa muiden booriyhdisteiden valmistukseen.
| Booritrifluoridi | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | 7637-07-2 |
| Ominaisuudet | |
| Molekyylikaava | BF3 |
| Moolimassa | 67,81 g/mol |
| Ulkomuoto | Väritön kaasu |
| Sulamispiste | –127 °C[1] |
| Kiehumispiste | –100 °C |
| Tiheys | 2,4 g/cm3 [1] |
| Liukoisuus veteen | 332 g/ml 0 °C |
|
|
|
Ominaisuudet
Huoneenlämmössä booritrifluoridi esiintyy värittömänä pistävänhajuisena kaasuna, joka muodostaa ilman kosteuden kanssa valkoisia huuruja[1]. Aine liukenee viileään veteen ja hiilivetyihin.[2] Lämpimämmän veden kanssa booritrifluoridi regoi muodostaen boorihappoa, fluoriboorihappoa ja vetyfluoridia. Aine myös syövyttää useita metalleja.[1] Aine reagoi myös voimakkaasti kloorattujen hiilivetyjen, alkyyli- ja bentsyylinitraattien, kalsiumoksidin, etyylieetterin ja jodin kanssa.[3] Aine aiheuttaa myös metallien korroosiota.
Valmistus
Ensimmäisen kerran booritrifluoridia valmistivat Louis Jacques Thénard ja Joseph Louis Gay-Lussac vuonna 1808. He valmistivat ainetta kuumentamalla booritrioksidin ja kalsiumfluoridin seosta.[4]
Booritrifluoridia syntyy myös valmistettaessa aromaattisia fluoriyhdisteitä, kuten fluoribentseeniä, Baltz-Scheimann- menetelmällä. Diatsoniumsuola muutetaan fluoriboorihapon avulla tetrafluoriboraattisuolaksi, joka hajotetaan kuumentamalla. Tällöin atsoniumryhmä korvautuu fluorilla ja vapautuu typpeä ja booritrifluoridia.[5]
Käyttö
Booritrifluoridia käytetään useissa erilaisissa kemiallisissa synteeseissä erityisesti polymerisaatioreaktioissa[3]. Lisäksi aineella on käyttöä elektroniikkateollisuudessa ja hyönteisten karkottamisessa.[2]
Turvallisuus
Booritrifluoridi on myrkyllistä. Hengitettynä aine aiheuttaa hengenahdistusta ja yskää. Silmiin joutuessaan aine aiheuttaa syövytysvammoja.[1] Limakalvoille joutuessaan aine muodostaa happamia ja syövyttäviä aineita. Lisäksi pitempiaikainen altistus voi aiheuttaa hammasvaurioita ja niveloireita. Eläinkokeissa havaittiin lisäksi vaikutuksia maksaan ja munuaisiin.[2] Aine on myrkyllistä ympäristölle ja erityisesti vesien eliöstölle.[1]
Lähteet
- Booritrifluoridin kansainvälinen kemikaalikortti Viitattu 5.2.2009
- Booritrifluoridi Kemian työsuojeluneuvottelukunta. Viitattu 28.11.2020.
- Richard P. Pohanish, Stanley A. Greene: Wiley Guide to Chemical Incompatibilities, s. 195. Wiley, 2003. ISBN 978-0-471-23859-1. Kirja Googlen teoshaussa (viitattu 5.2.2009). (englanniksi)
- Boron (symbol B, atomic weight I I) (Kopio Encyclopædia Britannican 11. painoksesta vuodelta 1911) Online Encyclopedia. Arkistoitu 5.9.2008. Viitattu 5.2.2009. (englanniksi)
- Brian Pearson: Speciality Chemicals, s. 42. Spring Innovations Ltd, 1991. ISBN 978-1-85166-646-1. Kirja Googlen teoshaussa (viitattu 5.2.2009). (englanniksi)


