Atsobentseeni
Atsobentseeni (C12H10N2) on aromaattisiin atsoyhdisteisiin kuuluva orgaaninen yhdiste. Yhdistettä voidaan käyttää muun muassa väriaineiden valmistukseen sekä akarisidinä.
| Atsobentseeni | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | |
| IUPAC-nimi | Difenyylidiatseeni |
| SMILES | C1=CC=C(C=C1)N=NC2=CC=CC=C2[1] |
| Ominaisuudet | |
| Kemiallinen kaava | C12H10N2 |
| Moolimassa | 182,22 g/mol |
| Tiheys | 1,203[2] g/cm³ |
| Sulamispiste | 68,5 °C[2] |
| Kiehumispiste | 293 °C (18 mmHg)[2] |
| Liukoisuus | Ei liukene veteen |
Ominaisuudet
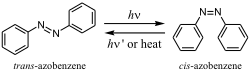
Huoneenlämpötilassa atsobentseeni on keltaisia tai punaoransseja kiteitä. Yhdiste on veteen liukenematonta ja liukenee orgaanisiin liuottimiin, esimerkiksi etanoliin, dietyylieetteriin ja etikkahappoon. Atsoyhdisteille tyypillisesti atsobentseenillä esiintyy cis-trans-isomeriaa. Isomeereista trans-isomeeri on stabiilimpi ja siten vallitseva muoto. Trans-atsobentseeni isomeroituu cis-isomeerikseen, kun sitä säteilytetään ultraviolettivalolla. Cis-atsobentseeni isomeroituu trans-isomeeriksi lämmityksen tai ultraviolettivalosäteilytyksen vaikutuksesta. Aine voidaan pelkistää hydratsobentseeniksi tai aniliiniksi.[2][3][4][5][6]
Atsobentseeni on myrkyllistä ja on myrkyllisyydeltään verrattavissa nitrobentseeniin. Yhdiste ärsyttää silmiä, ihoa ja hengitysteitä. Atsobentseeni saattaa olla karsinogeenista.[5][7]
Valmistus ja käyttö
Ensimmäisen kerran atsobentseeniä valmisti Eilhard Mitscherlich vuonna 1834 pelkistämällä nitrobentseeniä emäksisissä olosuhteissa. Nykyäänkin valmistus perustuu nitrobentseenin pelkistykseen joko raudan avulla happamissa olosuhteissa tai yleisemmin emäksisissä olosuhteissa sinkin tai natriumstanniitin avulla tai elektrolyyttisesti.[2][3][4][5][6]
Atsobentseeniä voidaan käyttää muun muassa väriaineiden, hyönteismyrkkyjen ja vulkanoinninkiihdyttimien valmistamiseen. Yhdistettä voidaan myös käyttää kasvihuoneissa punkkien hävittämiseen ja erityisen tehokas se on punkkien munia vastaan.[2][3][4][5]
Lähteet
- Azobenzene – Substance summary PubChem. NCBI. Viitattu 30.7.2017.
- Alén, Raimo: Kokoelma orgaanisia yhdisteitä: Ominaisuudet ja käyttökohteet, s. 689. Helsinki: Consalen Consulting, 2009. ISBN 978-952-92-5627-3.
- Susan Budavari (päätoim.): Merck Index, s. 157. 12th Edition. Merck & Co., 1996. ISBN 0911910-12-3. (englanniksi)
- Franz Müller, Hans Peter Streibert & Saleem Farooq: Acaricides, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2009. Viitattu 30.7.2017
- Thomas Scott, Mary Eagleson: Concise encyclopedia chemistry, s. 110. Walter de Gruyter, 1994. ISBN 978-3110114515. (englanniksi)
- Heinrich Zollinger: Color Chemistry, s. 184-187. John Wiley & Sons, 2003. ISBN 978-3906390239. Kirja Googlen teoshaussa (viitattu 30.7.2017). (englanniksi)
- Richard P. Pohanish: Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens, s. 301. William Andrew, 2017. ISBN 9780323389686. Kirja Googlen teoshaussa (viitattu 30.7.2017). (englanniksi)