C-vitamiini
C-vitamiini tarkoittaa L-askorbiinihappoa, joka on vitamiini ihmisille ja tietyille eliöille.[8] Lisäksi se voi tarkoittaa dehydroaskorbiinihappoa (DHA). DHA voi muuntua eläimissä L-askorbiinihapoksi.[8] Laajan määritelmän mukaan C-vitamiini on nimi kaikille aineille, joilla on samat toiminnot eliöissä kuin L-askorbiinihapolla.[2]
 | |
 | |
C-vitamiini | |
| Systemaattinen (IUPAC) nimi | |
| (R)-3,4-Dihydroksi-5-((S)-1,2-dihydroksietyyli)furan-2(5H)-oni | |
| Tunnisteet | |
| CAS-numero | |
| ATC-koodi | A11 |
| PubChem | |
| DrugBank | |
| Kemialliset tiedot | |
| Kaava | C6H8O6 |
| Moolimassa | 176,124 g/mol |
| Synonyymit | L-askorbaatti,[1] heksuronihappo, 2,3-didehydro-L-treo-heksano-1,4-laktoni[2] |
| Fysikaaliset tiedot | |
| Tiheys | 1,65[3] g/cm³ |
| Sulamispiste | 190–192 °C hajoaa[3] |
| Liukoisuus veteen | liukoinen[3] |
| Farmakokineettiset tiedot | |
| Hyötyosuus | nieltynä puutoksessa ~100 % (30 mg) ja tasapainotilassa 85 % (50 mg/vrk), 63 % (500 mg/vrk)[4] |
| Proteiinisitoutuminen | noin 25 %[5] |
| Metabolia | spontaani muunnos DHA:ksi, sitten 2,3-diketo-L-gulonihapoksi ja yhä muiksi aineiksi[6] |
| Puoliintumisaika | puutoksessa 8–40 pv, ylimäärin noin 30 min[7] |
| Ekskreetio | virtsa[5] |
| Terapeuttiset näkökohdat | |
| Raskauskategoria |
C(US)[5] |
| Reseptiluokitus | |
| Antotapa | nieltynä; sairauksissa: lihaspistos, pistos verenkiertoon[5] |
Selkärankaiset tarvitsevat L-askorbiinihappoa (tai DHA:ta). Useimmille se ei silti ole vitamiini, sillä pääosa pystyy tuottamaan sitä. Muun muassa ihmiset, muut kädelliset ja marsut eivät tuota askorbiinihappoa. Niiden tulee saada sitä ruuasta. Sen puutos aiheuttaa ihmisillä keripukkia.[1] Ihmisillä niellyt 3–4 g/vrk tai isommat askorbiinihappoannokset voivat aiheuttaa ripulia, mutteivät tiettävästi muuten ole haitallisia terveille.[6]
L-Askorbiinihappoa ja DHA:ta on eniten hedelmissä, marjoissa ja kasviksissa. Niitä ei juuri ole viljoissa, pähkinöissä, muissa siemenissä tai kasviöljyissä. Eläinperäisissä ruuissa niitä ei juuri ole, mutta maksoissa ja muissa elimissä niitä voi olla paljon.[9][10]
L-Askorbiinihappo on eläimissä ja kasveissa niitä radikaaleilta suojaava hapettumisenestoaine. Se reagoi radikaalien kanssa DHA:ksi.[11] Happo on myös joillain eliöillä tiettyjen entsyymien kofaktori eli entsyymireaktioissa pakollinen aine. Nisäkkäillä askorbiinihappoentsyymit ovat muun muassa osa kollageenin, karnitiinin ja norepinefriinin tuottoa. Happo myös lisää ruuan raudan imeytymistä pelkistäen ferrirautaa paremmin imeytyvään (Fe3+) ferromuotoon (Fe2+) ja tuottaa koordinaatiokompleksin tämän kanssa sen hapetuslukua suojaten.[4]
L-Askorbiinihappo on pH 7 liuoksissa ja solujen pH-arvossa monoanionina, jonka nimi on L-askorbaatti.[1]
L-Askorbiinihappoa, L-natriumaskorbaattia ja L-kalsiumaskorbaattia käytetään EU:ssa ruuissa hapettumisenestoaineina vastaavasti E-koodein E300, E301 ja E302.[12] L-Askorbyyli-6-palmitaatin ja L-askorbyyli-6-stearaatin koodit ovat vastaavasti E304(i) ja E304(ii) – nämä ovat 6-OH-ryhmän palmitiinihappo- ja steariinihappoestereitä.[13]
Saanti ja suositukset
Suomalaiset saavat ravinnostaan keskimäärin riittävästi C-vitamiinia eli 105 milligrammaa vuorokaudessa[14]. Peruna on suomalaisten tärkein C-vitamiinin lähde[15].
Suomen valtion ravitsemusneuvottelukunnan suositusten mukaan 6–65-vuotiaan tulisi joka vuorokausi (vrk) saada L-askorbiinihappoa keskimäärin 68 milligrammaa (mg), jos hänen energiatarpeensa on 2 000 kilokaloria vuorokaudessa.[16]
| Lapset | Miehet ja naiset |
Raskaana olevat | ||
|---|---|---|---|---|
| < 6 kk | a | 10–13 v | 50 | 85 |
| 6–11 kk | 20 | ≥ 14 v | 75 | |
| 12–23 kk | 25 | Imettävät | ||
| 2–5 v | 30 | 100 | ||
| 6–9 v | 40 | |||
| a: Äidinmaito tai äidinmaidonkorvike tyydyttää alle 6 kk ikäisten ravinnetarpeet | ||||
Liikasaanti
Aikuisille turvallinen enimmäismäärä L-askorbiinihappoa on 1 000 mg/vrk (1 g/vrk) Suomen valtion ravitsemusneuvottelukunnan mukaan.[16] Euroopan elintarviketurvallisuusvirasto ei ole esittänyt enimmäissuosituksia.[6] Nieltynä L-askorbiinihapon LD50 on rotille 6 996 mg/kg ja hiirille 4 380 mg/kg.[12]
Ihmisillä niellyt yli 3 g/vrk annokset L-askorbiinihappoa voivat aiheuttaa ripulia, mutteivät tiettävästi muuten ole haitallisia terveille.[6] Jopa 100 g askorbiinihappoa on annettu syöpäsairaille tiputusten kautta 2–3 kertaa viikossa muutaman kuukauden ajan ilman henkeä uhkaavia haittoja.[17] Suuriin annoksiin voi silti liittyä alla esitettyjä teoreettisia riskejä.
Suolistossa L-askorbiinihappo lisää raudan saantia pelkistäen ruuan ferrirautaa (Fe3+) paremmin imeytyvään ferromuotoon (Fe2+). Vitamiini voi myös vapauttaa ferrorautaa ferritiinistä ja lisätä raudan pelkistyksen kautta Fentonin reagenssin tapaisia haitallisia happiradikaaleja tuottavia reaktioita (katso kohta Reaktiot). Ei ole varmaa onko näillä reaktioilla merkitystä terveyden kannalta.[6] Kuitenkin raudan kertymäsairauksissa kuten hemokromatoosissa lisääntynyt raudan imeytyminen voi olla haitallista.[8]
Lisäksi glukoosi-6-fosfaattidehydrogenaasin puutosta (G6PDD) potevilla isot L-askorbiinihappoannokset aiheuttavat hemolyysiä. Syy on tiettävästi askorbiinihapon kyky lisätä punasoluja vaurioittavan vetyperoksidin tuottoa Fentonin reaktioin. G6PDD:ssä punasolujen NADPH-pitoisuus alenee. Glutationireduktaasi vaatii näitä kuluneen glutationin palautukseen glutationidisulfidista. Glutationia kuluu peroksidia tuhoavalla glutationiperoksidaasilla. Peroksidin poisto punasoluista on siis vähentynyt G6PDD:ssä.[18]
Munuaiskivissä noin 75 prosenttia on kalsiumoksalaattia. L-Askorbiinihappo hajoaa kehossa tuottaen muun muassa oksaalihappoa (katso kohta Hajotus ja erittyminen) ja siten kalsiumoksalaattia. Tämä voi munuaisissa virtsaan erittyessä tuottaa munuaiskiviä. Grammoissa mitattavat ja jatkuvat askorbiinihappoannokset voivat siis teoriassa lisätä munuaiskivien saannin riskiä.[8] Riskin kasvusta ei ole vahvaa näyttöä.[17]
Kemia
Rakenne
L-Askorbiinihappo on IUPAC:n suosittelema nimi.[3] Se on 6-hiilinen laktoni, jonka heterosyklinen rengas on 5:n atomin muodostama. Renkaassa on kaksoissidoksellinen dioli, 2,3-endioli.[2]

1a: L-askorbiinihappo
1b: D-askorbiinihappo
2a: L-isoaskorbiinihappo
2b: D-isoaskorbiinihappo eli erytorbiinihappo
L-Askorbiinihapolla on 2 kiraliakeskusta eli sillä 4 stereoisomeeriä. Näistä vain erytorbiinihappo on C-vitamiini. Se on vitamiinina vain noin 5 prosenttisesti yhtä tehokas kuin L-askorbiinihappo. L-Askorbiinihapolla on ainakin 5 tautomeeriä.[3]
Ominaisuudet
.JPG.webp)
L-Askorbiinihappo on valkea ja hajuton aine. Sen maku on hapan. Kiteet ovat monokliinisiä, levy- tai neulasmaisia. Se on liukoinen veteen (noin 0,33 g/ml), etanoliin (~0,02 g/ml), glyseroliin (~0,01 g/ml) ja propyleeniglykoliin (~0,05 g/ml). Se on liukenematon rasvoihin, öljyihin, dietyylieetteriin ja bentseeniin. Askorbiinihapon OH-ryhmät 3 ja 2 ovat happamia. Siksi sen 5 g/l vesiliuoksen pH-arvo on 3 ja 50 g/l pH on 2.[3] 25 °C 3-OH:n pKa on 4,04 ja 16 °C 2-OH:n pKa 11,7.[19] Askorbiinihappo on siis pH 7 vesiliuoksissa monoanionina eli askorbaattina.[1] 3-OH on hapan, sillä askorbaatin varaus delokalisoituu endiolin takia laktonin karbonyyliin (kuva alla) vakauttaen deprotonoitua muotoa.[3]

Reaktiot
L-Askorbiinihappo on pelkistin eli hapettumisenestoaine. Vesiliuoksissa happiradikaaleja neutraloidessaan se hapettuu dehydroaskorbiinihapoksi (DHA, kuva alla). Vesiliuoksissa DHA hydrolysoituu helposti 2,3-diketo-L-gulonihapoksi (CAS-numero 3445-22-5). DHA säilyy hajoamatta noin 4 °C vesiliuoksessa pH:ssa 2,5–5,5 usean päivän. Se voidaan pelkistää askorbiinihapoksi esimerkiksi vetysulfidilla, ditiotreitolilla tai kysteiinillä.[3]

Kosteuden lisäksi askorbiinihapon hajoamista lisäävät happi, emäksiset olot, kuumentaminen, valo ja siirtymämetallit. Taas pimeässä ja kuivassa kiinteä askorbiinihappo säilyy hyvin pitkään.[3] Askorbiinihapon DHA-hajoamistuote hajoaa yhä ja oloista riippuen hajoamistuotteita voi olla kymmeniä.[8] Niitä ovat muun muassa erilaiset furaanit, ketohapot ja karboksyylihapot.[21] Hapekkaissa oloissa DHA:sta saatu gulonihappo voi hajota muun muassa L-treonihapoksi (CAS 7306-96-9) ja oksaalihapoksi. Hapettomissa oloissa hajoaminen on noin 10-kertaa hitaampaa ja DHA:sta voi muodostua muun muassa furfuraalia ja hiilidioksidia ilman gulonihapon välillistä muodostumista.[3]
Vähäkin määrä siirtymämetalli-ioneita kuten rautaa(III) (Fe3+) ja kuparia(II) (Cu2+) katalysoivat askorbiinihapon hajoamista gulonihapoksi hapen (O2) läsnä ollessa. Ionit muodostavat tertiäärisen koordinaatiokompleksin endiolin OH-ryhmien ja hapen välille. Reaktiossa happi muuntuu vetyperoksidiksi (H2O2) ja askorbiinihappo DHA:ksi. Katalyysiä estävät ioneita sitovat kelaatit kuten EDTA, oksaalihappo ja sitruunahappo.[3] Metallien kuten Fe3+ ja Cu2+ läsnä ollessa askorbiinihappo (Asc) voi radikaalien neutraloinnin sijaan edistää niiden tuottoa Fentonin reagenssin tapaan:[12][9]
Bentsoehappo voi dekarboksyloitua askorbiinihapon ja siirtymämetallien katalysoimana syöpävaaralliseksi bentseeniksi. Vedessä on usein hieman metalleja kuten kuparia(II) ja rautaa(III). Siksi bentseeniä voi ilmetä esimerkiksi bentsoehappoa ja C-vitamiinia sisältävissä virvoitusjuomissa. Juomien bentseenipitoisuuksille on kuitenkin muun muassa EU:ssa säädetty turvallisena pidetty 1 μg/l maksimiarvo.[12]
Yhdenarvoisten emästen kanssa askorbiinihappo tuottaa suoloja. Kahdenarvoisten emästen suolat ovat epävakaita. L-Natrium- ja L-kalsiumaskorbaatissa ((C6H7O6)2Ca · 2 H2O) metalli-ioni on kiinni 3-OH:n hapessa.[3]

Askorbiinihapon OH-ryhmät voivat esteröityä. 6-OH tuottaa esterin vaikka palmitiinihapon kanssa tuottaen siis L-askorbyyli-6-palmitaattia (CAS 137-66-6). Rasvahappoesterit eivät ole vesiliukoisia. Eläimissä ne hydrolysoituvat ja muuntuvat vitamiinitoimintoiseksi askorbiinihapoksi.[13]
Kiehutettaessa L-askorbiinihappoa kaliumhydroksidin metanoliliuoksessa, se isomerisoituu L-isoaskorbiinihapoksi.[3]
Valmistus
L-Askorbiinihappoa tuotetaan teollisesti pääosin tiettyjen mikrobien avulla. Nämä tuottavat 2-keto-L-gulonihappoa, joka eristetään, puhdistetaan ja muunnetaan kemiallisella synteesillä L-askorbiinihapoksi. Suoraan askorbiinihappoa tuottavia mikrobimenetelmiä on, mutta nämä eivät ole kaupallisesti kannattavia. Ketogulonihappoa tuotetaan kaksivaiheisesti antamalla mikrobeille D-sorbitolia, jonka ne muuntavat L-sorboosiksi. Toisenlaiset mikrobit muuntavat sorboosin ketogulonihapoksi.[22]
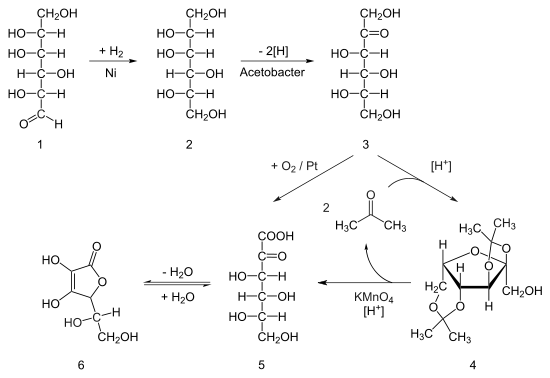
Ensimmäinen L-askorbiinihapon kaupallinen synteesi oli Reichstein-Grüssner-prosessi. Eräässä prosessin muunnelmassa D-glukoosi vedytetään Raney-nikkelillä suuressa paineessa ja lämpötilassa D-sorbitoliksi. Katalyytti poistetaan. Saanto on suuri ja vähäisiä sivutuotteita kuten D-mannitolia ei poisteta. Steriloitu sorbitoli hapetetaan mikrobein kuten Gluconobacter oxydans-bakteerien avulla L-sorboosiksi. Tämä puhdistetaan suodattamalla ja uudelleenkiteytystä käyttäen. Sorboosin OH-ryhmät suojataan asetonin avulla asetaaleiksi. Saadaan diasetoni-L-sorbofuranoosi. Reaktio tapahtuu liuoksessa, jossa on asetonin lisäksi ylimäärin vettä poistavaa ja katalyyttinä toimivaa rikkihappoa. Liuos pidetään reaktion ajan usein viileänä, kuten 4 °C:ssa. Liuos neutraloidaan ja diasetonisorbofuranoosi uutetaan vesiliuoksesta esimerkiksi tolueenilla. Suojaamaton OH-ryhmä hapetetaan karboksyylihapporyhmäksi suuressa lämpötilassa esimerkiksi kaliumpermanganaatilla lievästi emäksiseksi NaOH:lla tehdyssä liuoksessa. Asetonit poistetaan ja saadaan 2-keto-L-gulonihappoa. Tämä syklisoidaan esimerkiksi happokatalyysillä L-askorbiinihapoksi.[3]
Pitoisuudet ravinnossa
80–90 prosenttia ruokien C-vitamiinista on L-askorbiiniappoa lopun ollessa dehydroaskorbiinihappona, joka voi kehossa muuntua vitamiinitoimintoiseksi askorbiinihapoksi. C-vitamiinia on paljon useissa hedelmissä ja kasviksissa. Eläinperäisissä ruuissa sitä on elimissä kuten maksoissa ja munuaisissa, mutta lihaksissa sitä on hyvin vähän. Siemenissä vitamiinia ei juuri ole ja pitoisuudet kasvavat siemenen alkaessa itää.[9]
Runsaimpia C-vitamiinilähteitä ovat kakaduluumu (Terminalia ferdinandiana), jossa on askorbiinihappoa 406–5 320 mg/100 g hedelmälihaa. Camu camun (Myrciaria dubia) hedelmälihassa sitä on 877–3 133 mg/100 g.[23] Myös ruusunmarjoissa sitä on paljon. Puolikypsissä ja kypsissä kurtturuusun marjoissa pitoisuudet ovat 761–1 141 mg/100 g.[24]
Ruokien C-vitamiinipitoisuudet vaihtelevat muun muassa sadonkorjuun ajankohdasta, kuljetusoloista, säilytysoloista ja ruuanlaittotavoista riippuen. Happi, lämmitys[6] ja neutraalit tai emäksiset olot nopeuttavat myös hajoamista.[8]
Ruoan kuumennus vähentää sen C-vitamiinipitoisuutta. C-vitamiini säilyy parhaiten höyryttämällä kypsennetyssä ruoassa ja paistaminen on seuraavaksi paras ratkaisu. Keittäminen on huonoin ratkaisu etenkin, jos keitinvettä hyödynnetä ravinnoksi. Esimerkiksi perunoiden keitossa häviö on 40-88 prosenttia kuumuuden ja liukenemisen takia.[15][6]
C-vitamiinia hajoaa myös säilytettäessä ruokia pitkään, esimerkiksi perunoiden vitamiinista noin 50 prosenttia häviää viiden kuukauden kuluttua niiden keräämisestä. Pakastaminen hidastaa C-vitamiinin hajoamista.[9]
| Heinäkasvit ja jauhot | Pavut ja pähkinät | Lihat | |||
|---|---|---|---|---|---|
| kaurahiutale | 0 | cashewpähkinä, kuivapaahdettu | 0 | ankka, paahdettu | 0 |
| maissijauho, täysjyvä | 0 | härkäpapu, keitetty | 0,3 | kalkkuna, iholla, paahdettu | 0 |
| ohraryyni | 0 | kidneypapu, keitetty | 1,2 | kana, iholla, paahdettu | 0 |
| pasta, täysjyvä, keitetty | 0 | kikherne, keitetty | 1,3 | kirjolohi (viljelemätön), paistettu | 2,0 |
| riisi, tumma, keitetty | 0 | linssi, keitetty | 1,5 | makrilli, paistettu, kuivattu | 0,4 |
| riisi, valkoinen, keitetty | 0 | maapähkinä, kuivapaahdettu | 0 | nauta (vasikka), maksa, käristetty[25] | |
| ruisjauho, puolikarkea | 0 | manteli, kuivapaahdettu | 0,7 | nauta, kylki, ¼ rasvaa, pariloitu | 0 |
| soijajauho, rasvainen | 0 | parapähkinä, kuivapaahdettu | 0,7 | nauta, munuainen, pariloitu[25] | 0 |
| vehnäjauho, täysjyvä | 0 | pekaanipähkinä, kuivapaahdettu | 2,0 | sika, jalka, vähärasvainen, paahdettu | 0,4 |
| vehnälese | 0 | pistaasi, kuivapaahdettu | 7,3 | silli, säilyke | 0 |
| vehnänalkio | 0 | voipapu, keitetty | 10,1 | turska, paistettu | 1,0 |
| Kasvikset ja ruokasienet | Hedelmät ja marjat | Lehmänmaitotuotteet | |||
| bataatti, kuorimaton, uunipaistettu | 24,6 | aitoviikuna | 2,0 | briejuusto | 0 |
| herne | 40,0 | ananas | 15,4 | camembertjuusto | 0 |
| jääsalaatti | 3,9 | appelsiini | 53,2 | cheddarjuusto | 0 |
| keltasipuli | 6,4 | aprikoosi | 10,0 | edamjuusto | 0 |
| keräkaali, keitetty | 20,1 | avokado | 7,9 | maito, rasvaton | 0,98 |
| kukkakaali, keitetty | 44,3 | banaani | 9,1 | raejuusto, 1 % rasvaa | 0 |
| kurkku | 5,3 | hunajameloni | 42,2 | sinihomejuusto | 0 |
| lanttu | 18,8 | karviainen | 27,7 | voi | 0 |
| maissi, keltainen | 6,8 | luumu | 9,5 | kerma, 31,3 % rasvaa[25] | 0,61 |
| parsa, keitetty | 10,8 | mango | 27,7 | herajauhe, makea[25] | 1,49 |
| parsakaali, keitetty | 74,6 | mansikka | 56,7 | jugurtti, 3,3 % rasvaa[25] | 0,53 |
| peruna, kuorimaton, uunipaistettu | 12,8 | mustaherukka | 181,0 | Muut | |
| pinaatti | 28,1 | mustikka | 13,0 | kananmuna, keitetty | 0 |
| porkkana | 9,3 | omena | 5,7 | äidinmaito | 5,0 |
| punajuuri, keitetty | 3,6 | persikka | 6,6 | rypsiöljy | 0 |
| ruusukaali, keitetty[26] | 70 | päärynä | 4,0 | oliiviöljy | 0 |
| siitake, kuivattu | 3,5 | vadelma | 25,0 | olut, lager | 0 |
| tomaatti | 19,1 | viinirypäle | 34,4 | leivinhiiva, tuore (puristehiiva)[25] | 0 |
| a: ruuat ovat raakoja eli valmistamattomia ellei toisin mainita. Pitoisuudet ovat keskimääräisiä. | |||||
Toiminta eliöissä
Hapettumisenesto
L-Askorbiinihappo on soluja suojaava hapettumisenestoaine. Se neutraloi radikaaleja ja pysäyttää siten niiden soluja vaurioittavia ketjureaktioita. Askorbiinihapon vaikutuskohteena olevia radikaaleja ovat muun muassa superoksidianioni (O2•–), hydroksyyliradikaali (OH•), typpidioksidiradikaali (NO2•) ja erilaiset orgaaniset peroksyyliradikaalit (ROO•). Solujen rasvaliukoisissa osissa on myös E-vitamiineja. Nämä toimivat hapettumisenestoaineina muuntuen kromanoksyyliradikaaleiksi radikaaleja neutraloidessaan. Askorbiinihappo ja muutkin aineet, kuten glutationi, neutraloivat kromanoksyyliradikaaleja ja kierrättävät siten E-vitamiineja takaisin radikaaleilta suojaavaan muotoon.[9]

Solun pH-arvossa askorbiinihappo on askorbaatti-anionina (AscH–). Useimmin tämä reagoi soluissa peroksyyliradikaalin kanssa (ROO•) kanssa. Tämä neutraloituu peroksidiksi askorbaatin luovuttaessa sille ensin elektronin (e–) ja sitten protonin (H+). Askorbaatti reagoi anioninsa radikaaliksi, askorbyyliksi (AscH•–):[9][20]
- AscH– + ROO• → AscH• + ROO– → Asc•– + ROOH
Asc•– on verrattain vakaa. Se voi sopivissa oloissa säilyä sekuntien tai jopa minuuttien ajan, kun taas monien muiden radikaalien olemassaoloaika on alle millisekunnin.[4] Asc•– reagoi ensisijaisesti vain muiden radikaalien kanssa. Se voi luovuttaa toisen elektronin radikaalille muuntuen dehydroaskorbiinihapoksi (DHA). Todennäköisimmin se tuottaa dimeerin toisen Asc•–:n kanssa. Dimeeri hajoaa pian disproportionaatiossa. Muodostuu askorbaatti ja DHA:[20]
- 2 Asc•– + H+ → AscH– + DHA
DHA:lla on monia vaihtoehtoisia rakenteita. Vesiliuoksissa ja soluissa DHA ei ilmene 1,2,3-trikarbonyylinä edes välillisesti, vaan muina rakenteina. Pääasiallinen reaktioiden jälkeinen DHA on kaksirenkainen hemiketaali (kuva).[20]
DHA voi pelkistyä taas askorbiinihapoksi glutaredoksiinien avulla tai hajota (katso kohdat Imeytyminen ja kuljetus ja Hajotus ja erittyminen).[4]
Kofaktori
L-Askorbiinihappoa vaaditaan kofaktorina tiettyjen mono- ja dioksigenaaseihin kuuluvien entsyymien reaktioihin. Näiden aktiiviset kohdat käyttävät vastaavasti kuparin(I) (Cu+) ja raudan(II) (Fe2+) ioneita kofaktoreina, joiden hapetuslukua askorbiinihappo ylläpitää pelkistämällä.[1] Taulukossa alla on epätäydellinen lista nisäkkäiden askorbiinihappoentsyymeistä. On myös askorbiinihappoentsyymeitä, joita ei ole nisäkkäillä, mutta niitä on esimerkiksi tietyillä sienillä. Näitä ovat muun muassa tymiinidioksigenaasi (EC-numero 1.14.11.6), pyrimidiinideoksinukleosidi-1'-dioksigenaasi (EC 1.14.11.10) ja pyridiinideoksinukleosidi-2'-dioksigenaasi (EC 1.14.11.3).[4]
| Entsyymi[4] | Geeni(t) | EC | Toiminto[4] |
|---|---|---|---|
| Dopamiini-β-mono-oksigenaasi | DBH | 1.14.17.1 | Norepinefriinin tuotto |
| Peptidyyliglysiinimono-oksigenaasi | PAM | 1.14.17.3 | Peptidihormonien amidaatio |
| Prokollageeniproliini-3-dioksigenaasi | P3H1, P3H2, P3H3 | 1.14.11.7 | Kollageenin hydroksylaatio |
| Prokollageeniproliini-4-dioksigenaasi | P4HA1, P4HA2, P4HA3 | 1.14.11.2 | Kollageenin hydroksylaatio, hypoksian indusoiman tekijän hydroksylaatio |
| Prokollageenilysiini-5-dioksigenaasi | PLOD1, PLOD2, PLOD3 | 1.14.11.4 | Kollageenin hydroksylaatio |
| HIF-hydroksylaasi | HIF1AN | 1.14.11.30 | Hypoksian indusoiman tekijän säätely |
| Trimetyylilysiinidioksigenaasi | TMLHE | 1.14.11.8 | Karnitiinin tuotto |
| γ-Butyrobetaiinidioksigenaasi | BBOX1 | 1.14.11.1 | Karnitiinin tuotto |
| 4-Hydroksifenyylipyruvaattidioksigenaasi | HPD | 1.13.11.27 | Tyrosiinin hajotus |
Kollageenin proliinien ja lysiinien tulee hydroksyloitua translaation jälkeisesti 3-hydroksi- tai 4-hydroksiproliineiksi ja hydroksilysiineiksi, jotta kollageenista muodostuu normaalia. Hydroksylaatio tapahtuu taulukon prokollageenidioksigenaasien avulla. Hieman hydroksylaatiota voi tapahtua silti myös ilman näitä askorbiinihapporiippuvaisia entsyymeitä. Kollageeni on rakenteellisesti tärkeä osa ihoa ja muita sidekudoksia, joihin se tuottaa kudoksia vahventavia ristisidoksia. Siksi sen tuoton häiriö on tiettävästi pääsyy ihmisten keripukissa ilmeneviin haavaumiin, haavojen parantumisen heikkenemiseen ja ienten heikentymisestä johtuvaan hampaiden löystymiseen.[4]
Keripukki johtaa myös tyrosiinin hajotuksen heikkenemiseen, joka aiheuttaa tyrosinemiaa ja virtsan korkeita tyrosiinipitoisuuksia.[9] Keripukissa ilmenee myös väsymystä, joka voi johtua norepinefriinin, peptidihormonien ja/tai energia-aineenvaihduntaan osallisen karnitiinin tuoton vähäisyydestä.[4][9]
Raudan imeytyminen
L-Askorbiinihappo tehostaa samanaikaisesti syödyn hemiin sitoutuneen ja sitoutumattoman raudan imeytymistä ruuansulatuselimistöstä jopa 2–6-kertaisesti. Happamassa mahalaukussa hemiin sitoutumaton rauta on hapetusasteella Fe3+. Tämä ferrirauta pelkistyy askorbiinihapon avulla ferromuotoon (Fe2+), joka tuottaa askorbiinihapon kanssa hapetusastetta ylläpitävän, vakaan, vesiliukoisen ja helposti imeytyvän kelaatin. Rautapitoisen ruuan kanssa syöty askorbiinihappo kumoaa osin myös fytaattien ja polyfenolien tapaisten antiravintoaineiden raudan imeytymistä vähentävää vaikutusta.[9]
Muu biokemia
Imeytyminen ja kuljetus
Ihmisillä L-askorbiinihappo päätyy soluihin natriumriippuvaisten C-vitamiini kuljetinproteiinien (SVCT) kautta. Näitä on 2: SVCT1 (geeni SLC23A1) ja SVCT2 (SLC23A2). Näiden kalvoproteiinien läpi siirtyy 2 Na+-kationia per askorbaatti (Asc–) natrium-kaliumpumppujen ylläpitämän Na+-pitoisuuseron avulla. Kationit ja askorbaatti siirtyvät samaan suuntaan eli SVCT:t ovat symporttereita. SVCT1 siirtää askorbaattia noin 9-kertaa nopeammin kuin SVCT2, joka taas sitoo askorbaattia voimakkaammin (suuremmalla affinititeetilla).[27] SVCT2:tä on useimmissa kudoksissa. SVCT1:tä taas ei ole – sitä on kuitenkin muun muassa ohutsuolessa,[4] jossa lähinnä se vastaa askorbiinin imeytymisestä.[27] Dehydroaskorbiinihappoa (DHA) soluihin siirtävät glukoosin kuljetinproteiinit, joita ovat GLUT1, GLUT2, GLUT3, GLUT4 ja GLUT8 – näitä on useimmissa soluissa ja ne ovat uniporttereita. Kuljetus ulos soluista tapahtuu tuntemattomalla tavalla.[4]
Soluihin otettu DHA pelkistyy lähes heti L-askorbiinihapoksi suoralla kemiallisella pelkistyksellä tai entsymaattisesti dehydroaskorbiinihapporeduktaasin (EC-numero 1.8.5.1) aktiivisuuden omaavien glutaredoksiinien vaikutuksesta glutationia disulfidiksi hapettaen.[4]
Suolistosta imeydyttyään C-vitamiini kulkee veressä muihin kudoksiin. 120–180 min kuluttua askorbiinihapon syönnistä sen pitoisuudet plasmassa ovat suurimmillaan.[4] Veren vitamiinista 80–90 prosenttia on L-askorbiinihappoa. Loput ovat DHA:ta. Terveillä ihmisillä plasman askorbiinihappopitoisuus on 30–70 µmol/l tai enemmän.[9]
Varastoituminen
Aikuisissa ihmisissä isoimman L-askorbiinihappopitoisuuden kudoksia ovat aivolisäke (2 300–2 800 µM), lisämunuaiset (1 700–2 300 µM) ja mykiö (1 400–1 800 µM). Ison pitoisuuden omaavat myös veren imusolut (3 800 µM), monosyytit (3 100 µM) ja verihiutaleet (2 790 µM). Pitoisuudet ovat pienet punasoluissa (45 µM) ja syljessä (0,6 µM).[4]
Miehillä kehossa on arviolta enintään 1,5–2 g L-askorbiinihappoa. Alle 10 mg/vrk saanti johtaa alle 0,3 g kehon kokonaisvarantoon. Tämän rajan alittuessa ilmenevät keripukin ensioireet.[6] Aikuisilla ihmisillä keripukki ilmenee usein 45–80 päivän[9] tai jopa vasta 160 päivän kuluttua C-vitamiinien saannin loppumisesta.[4]
Hajotus ja erittyminen
Aikuisilla ihmisillä niellystä 100 mg/vrk L-askorbiinihappoannoksesta noin 25 prosenttia erittyy virtsaan sellaisenaan.[6] Noin 500 mg/vrk niellyn annoksen ylittävästä osasta lähes kaikki erittyy sellaisenaan virtsaan.[9]
Askorbiinihappo hapettuu helposti DHA:ksi. Tämä voi spontaanisti ja peruuttamattomasti hydrolysoitua avoketjuiseksi 2,3-diketo-L-gulonihapoksi (CAS-numero 3445-22-5).[6][8] Tämä voi hapettumalla katketa oksaalihapoksi ja L-treonihapoksi (CAS 7306-96-9), tai hiilidioksidia luovuttaen hapettua[8]
- L-ksyloosiksi (CAS 609-06-3)
- L-ksylonihapoksi (CAS 4172-44-5)
- L-lyksonihapoksi (CAS 4172-43-4)
Ihmisillä pääosa askorbiinihaposta kuitenkin erittyy sellaisenaan, DHA:na ja diketogulonihappona. Pieni osa erittyy oksaalihappona ja askorbaatti-2-sulfaattina (CAS 37627-95-5). Normaalein annoksin 24 tunnissa erittyneistä hajoamistuotteista lukumäärältään noin 1,5 prosenttia on oksaalihappoa.[9]
Kasvit

Kaikki kasvit tarvitsevat L-askorbiinihappoa ja tuottavat sitä Smirnoff-Wheeler-reitin kautta:[28]
- Glukoosista peräisin oleva fruktoosi-6-fosfaatti (fruktoosi-6-P) muuntuu mannoosifosfaatti-isomeraasilla mannoosi-6-P:ksi.
- Tämä muuntuu fosfomannomutaasilla (EC-numero 5.4.2.8) mannoosi-1-P:ksi.
- Tämä muuntuu GTP:n avulla mannoosi-1-fosfaattiguanyylitransferaasilla (EC 2.7.7.22) pyrofosfaatin poistuessa GDP-mannoosiksi.
- Tämä muuntuu GDP-mannoosi-3,5-epimeraasilla (EC 5.1.3.18) GDP-L-galaktoosiksi.
- Tämä muuntuu fosfaatin avulla GDP-L-galaktoosifosforylaasilla (EC 2.7.7.69) GDP:n poistuessa L-galaktoosi-1-P:ksi.
- Tämä muuntuu L-galaktoosi-1-fosfaattifosfataasilla (EC 3.1.3.93) fosfaatin poistuessa L-galaktoosiksi.
- Tämä muuntuu NAD+:n avulla L-galaktoosi-1-dehydrogenaasilla (EC 1.1.1.316) NADH:n poistuessa L-galaktono-1,4-laktoniksi.
- Tämä muuntuu L-galaktono-1,4-laktonidehydrogenaasilla (EC 1.3.2.3) L-askorbiinihapoksi.
Edeltävä reitti on yleisin. Vaihtoehtoisia ja mahdollisesti rinnakkaisia reittejä voi olla joissain kasveissa, mutta ne tunnetaan huonosti.[11]
Eläimet

Useimmat selkärankaiset tuottavat L-askorbiinihappoa. Tämän kyvyn ovat kuitenkin menettäneet evoluution myötä muun muassa ihmiset, muut kädelliset, varsinaiset luukalat, varpuslinnut, lepakot ja marsut. Näille eläimille aine on vitamiini. Kyvyttömyyden syy on tuottoon vaaditun L-gulonolaktonioksidaasin (EC 1.1.3.8) geenin toimimattomuuden aiheuttava mutaatio. Tuottoon pystyvät kalat, sammakkoeläimet ja matelijat tuottavat askorbiinihappoa pääosin munuaisissa, nisäkkäät taas maksassa.[1]
Askorbiinihapon tuottoon pystyvät eläimet tekevät sen seuraavasti:[1]
- D-glukoosi-1-fosfaatti (D-glukoosi-1-P) muuntuu UTP:n avulla UDP-glukoosi-difosforylaasilla (EC 2.7.7.9) pyrofosfaatin poistuessa UDP-glukoosiksi.
- Tämä muuntuu 2:n NAD+:n avulla UDP-glukoosi-6-dehydrogenaasilla (EC 1.1.1.22) 2:n NADH:n poistuessa UDP-glukuronaatiksi.
- Tämä muuntuu usean entsyymin katalysoiman 3:n vaihtoehtoisen reitin kautta D-glukuronaatiksi.
- Tämä muuntuu NADP+:n avulla glukuronaattireduktaasilla (EC 1.1.1.19) NADPH:n poistuessa L-gulonaatiksi.
- Tämä muuntuu gulonolaktonaasilla (EC 3.1.1.17) L-gulono-1,4-laktoniksi.
- Tämä muuntuu hapen avulla L-gulonolaktonioksidaasilla vetyperoksidin poistuessa L-askorbiinihapoksi.
Vaihtoehtoisesti L-gulonaatti (4. vaihe) voi askorbiinihapposynteesiin pystyvillä ja pystymättömillä eläimillä entsymaattisesti muuntua 3-keto-L-gulonaatiksi, sitten L-ksyluloosiksi, ksylitoliksi, D-ksyluloosiksi ja lopuksi D-ksyluloosi-5-P:ksi joka päätyy pentoosifosfaattireitille.[1]
Muut
Bakteerit eivät tiettävästi tuota askorbiinihappoa tai sen johdannaisia. Eukaryoottien synteesireitit vaihtelevat. Edeltävien kasvien ja eläinten reitin lisäksi on olemassa ainakin silmälevien käyttämä reitti, jossa muodostuu L-askorbiinihappoa. Sienet taas tuottavat ja käyttävät askorbiinihappoa tai sen erilaisin reitein tuotettuja johdannaisia kuten 6-deoksi-L-askorbaattia (CAS 528-81-4), askorbaattiglykosidejä ja D-erytroaskorbaattia. Jälkimmäistä 5-hiilistä molekyyliä tuottaa muun muassa leivinhiiva.[11]
Historia ja nimet
Keripukki on vanha tauti. Noin 1550 eaa. kirjoitettu Ebersin papyrus sisältää tiettävästi ensimmäisen kuvauksen keripukista – hoidoksi suositellaan sipulia ja vihanneksia. Sittemmin taudista on useita kuvauksia ja siihen on suositeltu eri hoitoja. Eräs näistä on ollut rohtokuirimon syönti. Tästä juontuu myös kasvin englanninkielinen nimi, scurvygrass ("keripukkiruoho").[29] Isoksi ongelmaksi keripukki nousi 1600- ja 1800-luvun välisten "uuteen maailmaan" suuntaavien laivamatkojen myötä, jolloin yli 2 miljoonaa merimiestä kuoli laivoilla keripukkiin vähän vihanneksia sisältävän ruokavalion takia.[8]
Toukokuussa 1747 James Lind oli kirurgina Ison-Britannian laivastossa ja teki ensimmäisen keripukin hoitoon pyrkivän järjestelmällisen kokeen. Kokeessa 12:sta keripukkia potevaa merimiestä jaettiin pareihin. Kunkin parin jäsenelle syötettiin eri ruokia ja aineita. 2 appelsiinia ja sitruunan päivässä saaneet paranivat, mutteivät muut. Lind kirjoitti kokeesta 1753 julkaistussa kirjassaan A treatise of the scurvy.[30][31] Hän tulkitsi tuloksensa väärin ja arveli keripukin ilmenevän merimiehillä meri-ilman takia uskoen, ettei tautia ole kuivalla maalla. Lindin teorian mukaan kostea meri-ilma tukki ihohuokosia ja sen viileys vähensi hikoilua. Tällöin kehossa muodostuvat keripukkia aiheuttavat jätteet eivät poistuneet hikoilemalla. Sitrushedelmillä taas oli Lindin mukaan huokosia avaava vaikutus.[31]

Sitruunoiden käyttöä alettiin kokeilemaan Britannian laivastossa lähinnä Gilbert Blanen (elänyt 1749–1834) ansiosta ja 1795 laivaston jäsenille alettiin antamaan tietyn kiintiön verran sitruunamehua.[32][31] 1845 perunarutto levisi Euroopassa, jota seurasi muun muassa Irlannin suuri nälänhätä. Peruna oli tuolloin paikoin tärkeä askorbiinihappolähde. Siksi keripukkia ilmeni tuolloin laajemmin myös maalla muun muassa Irlannissa. 1800-luvun puoliväliin mennessä ravitsemustiede oli kehittynyt ja hiilihydraattien, rasvojen ja proteiinien oli tunnistettu olevan energiaravintoaineita. Siksi hetken laajalti hyväksytty teoria oli se, että keripukki aiheutui typpiköyhästä eli vähäproteiinisesta ruokavaliosta. Sitten paikoin valtavirran teoriaksi nousi kaliumpuutos ja mikrobiteorian kehityksen myötä myös se, että keripukki onkin mikrobien levittämä tauti.[31]

Norjalainen Axel Holst (1830–1931) tutki skandinaavisilla merimiehillä yleistynyttä beriberiä. 1907 Holst ja Theodor Frølich (1870–1947) tekivät ruokintakokeita marsuilla pyrkiessään saamaan niille beriberin. Sen sijaan eläimillä ilmeni keripukin oireita. Ne paranivat annettaessa niille ruokia, jotka estivät keripukkia myös ihmisillä.[33][31] Holstin ja Frølichin löytö mahdollisti marsujen käytön koe-eläiminä myöhemmissä tutkimuksissa, joissa pyrittiin löytämään askorbiinihappopitoisin osa jostakin näytteestä, jotta kylliksi askorbiinihappoa voitaisiin eristää ja tutkia.[31]

Cambridgessa 1928 Albert Szent-Györgyi pyrki löytämään härän lisämunuaisten kuorikerroksesta vahvan pelkistimen, muttei keripukin estäjää. Hän eristi L-askorbiinihapon havaiten sen olevan etsimänsä aine, sillä se pelkisti pian jodin värittömäksi. Hän selvitti aineen oikean molekyylikaavan C6H8O6, muttei tunnistanut sen estävän keripukkia.[34][31] Hän aikoi kutsua ainetta julkaisussaan nimellä ignose (latinasta ignosco, "en tiedä")[35] ja sitten godnose (eng. god knows, "luoja tietää"), mutta julkaisun päätoimittajana toiminut Arthur Harden vastusti näitä nimiä. Harden ehdotti aineelle sen sijaan nimeä heksuronihappo, joksi se nimettiin. Nimi viittaa aineen kuuteen hiiliatomiin ja oletettuun hiilihydraattimaiseen rakenteeseen.[36][31]
Tietämättä keripukin estäjän olevan pelkistin ja että se on jo löydetty, useat tutkijaryhmät käyttivät jodin tapaisten nopeiden menetelmien sijaan viikkoja kestäviä marsukokeita pyrkiessään eristämään taudin parantavan aineen. Charles Glen King (1896–1988) ja kollegat olivat ensimmäiset. 1931 he eristivät Pittsburghin yliopistossa L-askorbiinihapon sitruunamehusta ja tunnistivat sen olevan keripukkia estävä aine.[37][31] 1932 he havaitsivat että se on sama kuin Györgyin eristämä. Vain Györgyille myönnettiin lääketieteen Nobel-palkinto 1937 osin askorbiinihapon löytämisen takia.[38][31][39]
1933 Györgyi ja Walter Haworth keksivät heksuronihapolle korvaavan nimen, askorbiinihappo. Tämä tulee sanasta antiscorbutic, joka on sananmukaisesti "keripukin estäjä".[40]
Edmund Langley Hirstin askorbiinihapon rakennetutkimuksiin pohjaten Walter Haworth selvitti 1933 Birminghamin yliopistossa L-askorbiinihapon rakennekaavan, stereoisomerian ja syntetisoi aineen ensimmäisenä. Haworthille myönnettiin 1937 tästä ja muista töistään Paul Karrerin kanssa jaettu kemian Nobel-palkinto.[41][31][42]
Myöhemmin 1933 Tadeusz Reichstein, Andreas Grüssner ja Rupert Oppenauer kehittävät ensimmäisen kaupallisesti kannattavan teollisen L-askorbiinihapon synteesin. Tämä säilyi siihen jälkikäteen tehdyin muunnelmin pitkään teollisuuden tärkeimpänä synteesinä.[43][3] Vasta 1960-luvun lopulla puolisynteettiset mikrobimenetelmät alkoivat yleistymään.[22]
Katso myös
Lähteet
- GF Combs et al: The vitamins: fundamental aspects in nutrition and health. 3. painos. Elsevier Academic Press, 2008. ISBN 9780121834937.
Viitteet
- CL Linster, E Schaftingen: Vitamin C. Biosynthesis, recycling and degradation in mammals. The FEBS Journal, 2007, 274. vsk, nro 1, s. 1–22. PubMed:17222174. doi:10.1111/j.1742-4658.2006.05607.x. ISSN 1742-4658. Artikkelin verkkoversio. (Arkistoitu – Internet Archive)
- Combs, s. 51-52
- M Eggersdorfer et al: ”Vitamins”, Ullmann's encyclopedia of industrial chemistry, s. 110–123. American Cancer Society, 2000. ISBN 9783527306732. Teoksen verkkoversio.
- SJ Padayatty, M Levine: Vitamin C physiology: the known and the unknown and Goldilocks. Oral diseases, 2016, 22. vsk, nro 6, s. 463–493. PubMed:26808119. doi:10.1111/odi.12446. ISSN 1354-523X. Artikkelin verkkoversio.
- Ascorbic Acid Drugs.com. Viitattu 14.8.2019.
- Scientific opinion on dietary reference values for vitamin C. EFSA Journal, 2013, 11. vsk, nro 11, s. 3 418. doi:10.2903/j.efsa.2013.3418. ISSN 1831-4732. Artikkelin verkkoversio. (Arkistoitu – Internet Archive)
- J Duconge et al: Pharmacokinetics of vitamin C: insights into the oral and intravenous administration of ascorbate. Puerto Rico Health Sciences Journal, 2008, 27. vsk, nro 1, s. 7–19. PubMed:18450228. ISSN 0738-0658. Artikkelin verkkoversio.
- Zempleni, J. et al.: Handbook of vitamins, s. 490–510. 4. painos. Taylor & Francis, 2007. ISBN 9780849340222. (englanniksi)
- Combs, s. 236–262
- Combs, s. 528–560
- G Wheeler et al: Evolution of alternative biosynthetic pathways for vitamin C following plastid acquisition in photosynthetic eukaryotes. eLife, 2015, 4. vsk. PubMed:25768426. doi:10.7554/eLife.06369. ISSN 2050-084X. Artikkelin verkkoversio.
- Scientific opinion on the re-evaluation of ascorbic acid (E 300), sodium ascorbate (E 301) and calcium ascorbate (E 302) as food additives. EFSA Journal, 2015, 13. vsk, nro 5, s. 4087. doi:10.2903/j.efsa.2015.4087. ISSN 1831-4732. Artikkelin verkkoversio. [vanhentunut linkki]
- Scientific Opinion on the re-evaluation of ascorbyl palmitate (E 304(i)) and ascorbyl stearate (E 304(ii)) as food additives. EFSA Journal, 2015, 13. vsk, nro 11, s. 4289. doi:10.2903/j.efsa.2015.4289. ISSN 1831-4732. Artikkelin verkkoversio. [vanhentunut linkki]
- Ravitsemus Suomessa – FinRavinto 2017 -tutkimus. Sivu 110. https://www.julkari.fi/bitstream/handle/10024/137433/Raportti_12_2018_netti%20uusi%202.4.pdf?sequence
- Teksti: Martin Kreutzer 24 elokuuta 2021: 10 luuloa perunasta KUNTO PLUS. 24.8.2021. Viitattu 6.3.2022.
- Suomalaiset ravitsemussuositukset 2014, s. 49, 51. 5. painos. Valtion ravitsemusneuvottelukunta, 2018. ISBN 9789524538015. Teoksen verkkoversio.
- M Prier, AC Carr, N Baillie: No reported renal stones with intravenous vitamin C administration: a prospective case series study. Antioxidants, 2018, 7. vsk, nro 5. PubMed:29883396. doi:10.3390/antiox7050068. ISSN 2076-3921. Artikkelin verkkoversio.
- J Quinn et al: Effect of high-dose vitamin C infusion in a glucose-6-phosphate dehydrogenase-deficient patient. Case Reports in Medicine, 2017, s. 1–4. PubMed:29317868. doi:10.1155/2017/5202606. ISSN 1687-9627. Artikkelin verkkoversio.
- WM Haynes et al: ”5”, CRC handbook of chemistry and physics, s. 98. 95. painos. CRC Press, 2014. ISBN 9781482208689.
- Y Tu, D Njus, HB Schlegel: A theoretical study of ascorbic acid oxidation and HOO/O2 radical scavenging. Organic & Biomolecular Chemistry, 2017, 15. vsk, nro 20, s. 4417–4431. PubMed:28485446. doi:10.1039/C7OB00791D. ISSN 1477-0520. Artikkelin verkkoversio.
- AN Hiatt et al: Deliquescence behavior and chemical stability of vitamin C forms (ascorbic acid, sodium ascorbate, and calcium ascorbate) and blends. International Journal of Food Properties, 2011, 14. vsk, nro 6, s. 1330–1348. doi:10.1080/10942911003650338. ISSN 1094-2912. Artikkelin verkkoversio.
- M Eggersdorfer et al: One hundred years of vitamins-a success story of the natural sciences. Angewandte Chemie International Edition, 2012, 51. vsk, nro 52, s. 12960–12990. PubMed:23208776. doi:10.1002/anie.201205886. ISSN 1742-4658. Artikkelin verkkoversio.
- Šmíd, J. et al.: Morphological and genetic diversity of camu-camu [Myrciaria dubia (Kunth) McVaugh] in the Peruvian Amazon. PLoS ONE, 2017, 12. vsk, nro 6. PubMed:28658316. doi:10.1371/journal.pone.0179886. ISSN 1932-6203. Artikkelin verkkoversio. (englanniksi)
- A Al-Yafeai, P Bellstedt, V Böhm: Bioactive compounds and antioxidant capacity of rosa rugosa depending on degree of ripeness. Antioxidants, 2018, 7. vsk, nro 10. PubMed:30282929. doi:10.3390/antiox7100134. ISSN 2076-3921. Artikkelin verkkoversio. (englanniksi)
- Ensminger, M. E. et al.: ”6 F”, The concise encyclopedia of foods & nutrition. CRC Press, 1995. ISBN 9780849344558. (englanniksi)
- https://fineli.fi/fineli/fi/elintarvikkeet/3349
- R Figueroa-Méndez, S Rivas-Arancibia: Vitamin C in health and disease: its role in the metabolism of cells and redox state in the brain. Frontiers in Physiology, 2015, 6. vsk, nro 397. PubMed:26779027. doi:10.3389/fphys.2015.00397. ISSN 1664-042X. Artikkelin verkkoversio.
- SG Clarke et al: Arabidopsis VTC2 encodes a GDP-L-galactose phosphorylase, the last unknown enzyme in the Smirnoff-Wheeler pathway to ascorbic acid in plants. Journal of Biological Chemistry, 2007, 282. vsk, nro 26, s. 18879–18885. PubMed:17462988. doi:10.1074/jbc.M702094200. ISSN 0021-9258. Artikkelin verkkoversio.
- E Magiorkinis, A Beloukas, A Diamantis: Scurvy: past, present and future. European Journal of Internal Medicine, 2011, 22. vsk, nro 2, s. 147–152. PubMed:21402244. doi:10.1016/j.ejim.2010.10.006. Artikkelin verkkoversio.
- James Lind: A treatise of the scurvy, s. 191–196. OCLC: 83267069. A. Kincaid & A. Donsaldson, 1753. Teoksen verkkoversio.
- KJ Carpenter: The discovery of vitamin C. Annals of Nutrition & Metabolism, 2012, 61. vsk, nro 3, s. 259–264. PubMed:23183299. doi:10.1159/000343121. ISSN 1421-9697. Artikkelin verkkoversio.
- M Wharton: Sir Gilbert Blane Bt (1749–1834). Annals of The Royal College of Surgeons of England, 1984, 66. vsk, nro 5, s. 375–376. PubMed:6385804. ISSN 0035-8843. Artikkelin verkkoversio.
- A Holst, T Frølich: Experimental studies relating to "ship-beri-beri" and scurvy. The Journal of Hygiene, 1907, 7. vsk, nro 5, s. 634–671. PubMed:20474337. doi:10.1017/s0022172400033623. ISSN 0022-1724. Artikkelin verkkoversio.
- A Szent-Györgyi: Observations on the function of peroxidase systems and the chemistry of the adrenal cortex. Biochemical Journal, 1928, 22. vsk, nro 6, s. 1387–1409. PubMed:16744155. doi:10.1042/bj0221387. ISSN 0264-6021. Artikkelin verkkoversio.
- GR Buettner, FQ Schafer: Albert Szent-Gyorgyi: vitamin C identification. Biochemical Journal, 2006. doi:10.1042/BJ2006c005. ISSN 0264-6021. Artikkelin verkkoversio.
- MC De Tullio: Beyond the antioxidant: the double life of vitamin C. (myös ISBN 9789400721999, 2012, s. 49) Sub-Cellular Biochemistry, 2012, 56. vsk, s. 49–65. PubMed:22116694. doi:10.1007/978-94-007-2199-9_4. ISSN 0306-0225. Artikkelin verkkoversio.
- CG King, FL Smith: The preparation and storage of vitamin C concentrates from lemon juice. Journal of Biological Chemistry, 1.12.1931, 94. vsk, nro 2, s. 491–496. ISSN 0021-9258. Artikkelin verkkoversio.
- CG King, WA Waugh: The chemical nature of vitamin C. Science, 1.4.1932, 75. vsk, nro 1944, s. 357–358. PubMed:17750032. doi:10.1126/science.75.1944.357-a. ISSN 0036-8075. Artikkelin verkkoversio.
- The Nobel Prize in Physiology or Medicine 1937 NobelPrize.org.
- WN Haworth, A Szent-Györgyi: "Hexuronic acid" (ascorbic acid) as the antiscorbutic factor. Nature, 1933, 131. vsk, nro 3297, s. 24–24. doi:10.1038/131024b0. ISSN 1476-4687. Artikkelin verkkoversio.
- WN Haworth: The constitution of ascorbic acid. Journal of the Society of Chemical Industry, 1933, 52. vsk, nro 23, s. 482–485. doi:10.1002/jctb.5000522303. ISSN 1934-9971. Artikkelin verkkoversio.
- The Nobel Prize in Chemistry 1937 NobelPrize.org.
- T Reichstein, A Grüssner, R Oppenauer: Die synthese der d-ascorbinsäure (d-form des C-vitamins). Helvetica Chimica Acta, 1933, 16. vsk, nro 1, s. 561–565. doi:10.1002/hlca.19330160177. ISSN 1522-2675. Artikkelin verkkoversio.
Aiheesta muualla
- Fineli: C-vitamiinin lähteet ruoka-aineissa
- Linus Pauling Institute: Vitamin C (englanniksi)
- PubChem: Ascorbic acid (englanniksi)
- Human Metabolome Database: Ascorbic acid
- DrugBank: Ascorbic acid (englanniksi)
- Kyoto Encyclopedia of Genes and Genomes (KEGG): L-Ascorbic acid
- Food Component Database (FooDB): L-Ascorbic acid (englanniksi)
- Liber Herbarum II: C-vitamiinia sisältäviä kasveja
- Pherobase: Semiochemical - ascorbic acid (englanniksi)
- Molecule of the Month: Vitamin C, (L-ascorbic acid). Bristol University School of Chemistry. (englanniksi)