Antimonitrioksidi
Antimonitrioksidi (Sb2O3) on yksi antimonin oksideista. Yhdistettä käytetään estämään kankaiden ja muovien palamista, antimonin ja antimoniyhdisteiden valmistukseen sekä katalyyttinä. Yhdisteestä käytetään myös nimiä antimoniseskvioksidi, antimoni(III)oksidi ja antimonivalkoinen.
| Antimonitrioksidi | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | 1309-64-4 |
| Ominaisuudet | |
| Molekyylikaava | Sb2O3 |
| Moolimassa | 291,52 |
| Ulkomuoto | Kiteinen valkoinen aine[1] |
| Sulamispiste | 656 °C[1] |
| Kiehumispiste | 1 550 °C[1] |
| Tiheys | 5,2 g/cm3[1] |
| Liukoisuus veteen | Huono[1] |
Rakenne ja ominaisuudet
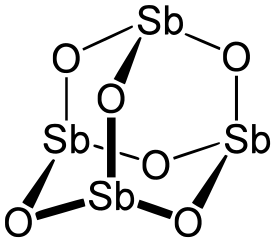
Antimonitrioksidilla on kiinteässä olomuodossa kaksi alkeiskopiltaan eroavaa kidemuotoa, jotka muodostuvat Sb4O6-yksiköistä. Näistä huoneenlämpötilassa stabiilimpi on kuutiollinen muoto, joka esiintyy luonnossa senarmontiittimineraalissa. Kuutiollinen antimonitrioksidi muuntuu alkeiskopiltaan ortorombiseksi yli 570 °C:n lämpötilassa. Ortorombista antimonitrioksidia esiintyy luonnossa valentiniittimineraalissa. Kuumennettaessa yhdistettä se muuttuu väriltään kellertäväksi, mutta palautuu valkoiseksi jäähdytettäessä. Nestemäisessä ja kaasumaisessa olomuodossa antimonitrioksidi esiintyy dimeerisenä Sb4O6-molekyylinä. Antimonitrioksidi liukenee erittäin huonosti veteen. Happoihin se liukenee sen sijaan hyvin. Yhdiste on luonteeltaan amfoteerinen ja emäksiin se liukenee heksahydroksoantimonaatti- eli antimoniitti-ionina ([Sb(OH)6]3-). Kuumennettaessa antimonitrioksidia 700–1 000 °C:n lämpötilaan hapen läsnä ollessa se hapettuu antimonitetroksidiksi.[1][2][3][4]
Antimonitrioksidi ärsyttää hengitystietä ja ihoa. Yhdiste saattaa olla ihmiselle karsinogeeninen.[5]
Valmistus ja käyttö
Antimonitrioksidia muodostuu kuumentamalla antimonia ilman hapen läsnä ollessa. Muita teollisuudessa käytettyjä yhdisteen valmistusmenetelmiä ovat antimonitrisulfidin pasutus tai antimonitrisulfidin tai antimonitrikloridin hydrolyysi veden tai vesihöyryn avulla.[1][2][3][4]
- 4 Sb + 3 O2 → 2 Sb2O3
- 2 Sb2S3 + 9 O2 → 2 Sb2O3 + 6 SO3
Antimonitrioksidin tärkein käyttökohde on toimia paloa estävänä lisäaineena kankaissa ja muoveissa yhdessä halogeenien kanssa. Sitä lisätään muun muassa polyvinyylikloridi- polyesteri- ja polyamidimuoveihin. Muoveissa se toimii myös stabilisaattorina. Muita käyttökohteita ovat lasin kirkastaminen, emalien ja lasitteiden valmistus, antimoniyhdisteiden synteesi ja polyestereiden valmistuksessa polymeroitumisreaktion katalyyttinä toimiminen.[1][2][3]
Lähteet
- E. M. Karamäki: Epäorgaaniset kemikaalit, s. 204. Kustannusliike Tietoteos, 1983. ISBN 951-9035-61-3.
- Leon D. Freedman, G. O. Doak, G. Gilbert Long, Tariq Mahmood & Charles B. Lindhaal :Antimony Compounds, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2003. Viitattu 9.11.2013
- Sabina C. Grund, Kunibert Hanusch, Hans J. Breunig & Hans Uwe Wolf: Antimony and Antimony Compounds, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2006. Viitattu 9.11.2013
- Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: Inorganic chemistry, s. 763. Academic Press, 2001. ISBN 978-0-12-352651-9. Kirja Googlen teoshaussa (viitattu 9.11.2013). (englanniksi)
- Antimonitrioksidin kansainvälinen kemikaalikortti. Viitattu 9.11.2013