Antimonitetroksidi
Antimonitetroksidi tai antimoni(III,V)oksidi (Sb2O4) on antimonin oksideihin kuuluva epäorgaaninen yhdiste. Yhdistettä käytetään katalyyttinä ja erikoiskeraamien valmistukseen. Yhdistettä esiintyy luonnossa servantiittimineraalina.[4][5][6]
| Antimonitetroksidi | |
|---|---|
 |
|
| Tunnisteet | |
| CAS-numero | 1332-81-6 |
| Ominaisuudet | |
| Molekyylikaava | Sb2O4 |
| Moolimassa | 307,52 |
| Ulkomuoto | Valkoinen kiteinen aine[1] |
| Sulamispiste | > 930 °C (hajoaa)[2] |
| Tiheys | 6,64 g/cm3[3] |
| Liukoisuus veteen | Ei liukene veteen |
Ominaisuudet
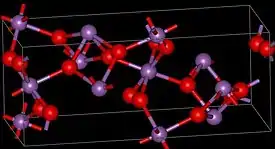
Huoneenlämpötilassa antimonitetraoksidi on valkoista kiteistä ainetta. Yhdisteessä antimoni esiintyy sekä hapetusluvulla +III että hapetusluvulla +V eli se on niin kutsuttu kaksoisoksidi tai suolaoksidi.[1] Antimonitetroksidi on polymorfista ja siitä tunnetaan kaksi kiderakenteeltaan erilaista muotoa: alkeiskopiltaan ortorombinen α-Sb2O4 ja alkeiskopiltaan monokliininen β-Sb2O4. Näistä α-muodon rakenne on kerrosmainen. Hapetusluvulla +V oleva antimoni on koordinoitunut kuuteen happiatomiin muodostaen oktaedrin ja näiden välissä on antimoni muodostanut tasoja hapetusluvulla +III, joka on koordinoitunut neljään happiatomiin, kahteen tason yläpuolella ja kahteen tason alapuolella.[4][6]
Antimonitetroksidi on käytännöllisesti katsoen lähes liukenematonta veteen. Se liukenee väkeviin emäsliuoksiin, mutta ei happoihin. Kuumennettaessa yli 930 °C:n se hajoaa antimonitrioksidiksi. Yhdiste voidaan pelkistää metalliseksi antimoniksi sulattamalla hiilen tai kaliumsyanidin kanssa.[2][4][5][6]
Valmistus ja käyttö
Antimonitetroksidia voidaan valmistaa kuumentamalla antimonitrioksidia hapen läsnä ollessa 400–500 °C:n lämpötilassa tai kuumentamalla antimonipentoksidia noin 800 °C;n lämpötilaan. Kolmas tapa on antimonitrisulfidin kuumentaminen. Näin muodostuu α-muotoa, joka voidaan muuttaa β-muodoksi kuumentamalla kuivassa ilmakehässä. Toinen tapa β-muodon valmistamiseen on antimonihapon kuumentaminen 900 °C:n lämpötilaan.[1][2][4][5][6]
- 2 Sb2O3 + O2 → 2 Sb2O4
- 2 Sb2O5 → 2 Sb2O4 + O2
Antimonitetroksidia käytetään eräiden keraamien valmistuksessa ja katalyyttinä hapetettaessa alkeeneja alkyyneiksi.[4][5]
Lähteet
- E. M. Karamäki: Epäorgaaniset kemikaalit, s. 205. Kustannusliike Tietoteos, 1983. ISBN 951-9035-61-3.
- Thomas Scott, Mary Eagleson: Concise encyclopedia chemistry, s. 84. Walter de Gruyter, 1994. ISBN 978-3110114515. Kirja Googlen teoshaussa (viitattu 2.6.2015). (englanniksi)
- William M. Haynes, David R. Lide, Thomas J. Bruno: CRC Handbook of Chemistry and Physics, s. 4.49. 93rd Edition. CRC Press, 2012. ISBN 978-1439880494. Kirja Googlen teoshaussa (viitattu 2.6.2015). (englanniksi)
- Leon D. Freedman, G. O. Doak, G. Gilbert Long, Tariq Mahmood & Charles B. Lindhal: Antimony Compounds, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2003. Viitattu 2.6.2015
- Sabina C. Grund, Kunibert Hanusch, Hans J. Breunig & Hans Uwe Wolf: Antimony and Antimony Compounds, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2006. Viitattu 2.6.2015
- Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: Inorganic chemistry, s. 765. Academic Press, 2001. ISBN 978-0-12-352651-9. Kirja Googlen teoshaussa (viitattu 2.6.2015). (englanniksi)