Angiotensiini
Angiotensiinit (AT) ovat peptidejä ja hormoneita, joita on ihmisillä 4 päätyyppiä: I, II, III ja IV. Näistä AT II supistaa verisuonia eniten kohottaen siten verenpainetta.[1] Se myös lisää verenpainetta lisäävän aldosteronin tuottoa.[2] Angiotensinogeeni on maksassa muodostuva AT:iden esiaste, joka pilkkoutuu munuaisista tulleen veren reniinin avulla AT I:ksi. AT I pilkkoutuu AT II:ksi angiotensiinikonvertaasilla. AT II pilkkoutuu yhä muiksi AT:iksi.[1]

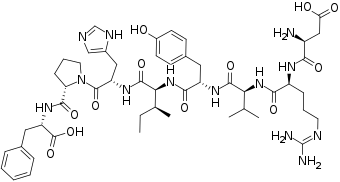
Reniini, aldosteroni ja lähinnä AT II ovat osa verenpainetta säätävää reniini-angiotensiini-aldosteronijärjestelmää. Järjestelmä on kaikilla selkärankaisilla ja on niiden verenpainetta säätelevistä järjestelmistä usein keskeisin, muttei ainoa. Järjestelmän yksityiskohdat vaihtelevat lajeittain.[3] Esimerkiksi angiotensinogeenin ja AT:iden rakenne on lajikohtaista.[4]
Angiotensinogeeni
Angiotensinogeeniä muodostuu pääosin vain maksassa, josta se erittyy vereen. Ihmisillä angiotensinogeenin pituus on 485 aminohappoa, jonka N-terminaalista poistuu 33:n aminohapon signaalisekvenssi angiotensinogeenin muodostumisen eli translaation jälkeen.[4] Ihmisten angiotensinogeenin geeni on AGT ja se on kromosomi 1:ssä.[5]
Ihmisillä reniini poistaa angiotensinogeenin N-terminaalista 10 aminohapon pätkän. Pätkä on angiotensiini I.[4]
Angiotensiinit
| Nimi | Aminohappo- sekvenssi |
g/mol |
|---|---|---|
| Angiotensiini I | DRVYIHPFHL | 1 296.5 |
| Angiotensiini II | DRVYIHPF | 1 046.2 |
| Angiotensiini III | RVYIHPF | 931.1 |
| Angiotensiini IV | VYIHPF | 774.9 |
| Angiotensiini (1–12) | DRVYIHPFHLLY | 1 572.8 |
| Angiotensiini (1–9) | DRVYIHPFH | 1 183.3 |
| Angiotensiini (2–10) | RVYIHPFHL | 1 181.4 |
| Angiotensiini A | ARVYIHPF | 1 002.2 |
| Angiotensiini (1–7) | DRVYIHP | 899.0 |
| Alamandiini | ARVYIHP | 855.0 |
| Angiotensiini (1–5) | DRVYI | 664.8 |
| Angiotensiini (1–4) | DRVY | 551.6 |
Angiotensiini I
Angiotensiini I hajoaa angiotensiinikonvertaasilla angiotensiiniksi II.[6]
Angiotensiini II
Ihmisillä veren angiotensiini II sitoutuu agonistina (aktivoijana) angiotensiini II reseptorin alatyyppeihin 1 ja 2 eli AT1- ja AT2-reseptoreihin. Sitoutuminen suonten endoteelisolujen AT1-reseptoreihin saa aikaan suonten supistumisen ja verenpaineen nousun kehossa.[1] Angiotensiinin II sitoutuminen lisämunuaisten pintakerroksen (zona glomerulosa) AT1-reseptoreihin lisää kolesterolin tuontia lisämunuaissolujen mitokondrioihin ja aldosteronisyntaasien tuottoa. Syntaasit tuottavat kolesterolin aineenvaihduntatuotteista vereen aldosteronia, joka sitoutuu munuaisten distaalisissa tiehyissä aktivoivasti mineralokortikoidireseptoreihin. Näiden tumareseptorien aktivointi vähentää natriumin ja veden päätymistä virtsaan sekä lisää kaliumin poistumista virtsaan. Vesi lisää veren tilavuutta ja siten verenpainetta.[2]
Angiotensiini II hajoaa glutamyyliaminopeptidaasilla (EC-numero 3.4.11.7) angiotensiiniksi III.[6]
Angiotensiini III
Ihmisillä angiotensiini III sitoutuu AT1- ja AT2-reseptoreihin. Sen affiniteetti AT1-reseptoreille on pienempi kuin angiotensiinillä II, joten angiotensiinin III kyky nostaa verenpainetta on heikompi.[1]
Angiotensiini III hajoaa alaniiniaminopeptidaasilla (EC 3.4.11.2) angiotensiiniksi IV.[6]
Verenpainetta laskeva reitti
Eri angiotensiinit voivat ohjautua liialta suonten supistumiselta suojaavalle reitille, jonka aineenvaihduntaa esitellään alla. Reitin entsyymien keskinäiset aktiivisuudet vaihtelevat kudoskohtaisesti.[6] Alla ei ole lueteltu jo aiemmin mainittuja entsyymireaktioita, joissa angiotensiinit I, II, III ja IV muuntuvat toisikseen.
Ihmisillä angiotensiini I voi hajota angiotensiiniksi (1–12) tuntemattomalla tavalla, joka hajoaa kymaasien (EC-numero 3.4.21.39) avulla angiotensiiniksi II, joka dekarboksyloituu dekarboksylaasilla angiotensiini A:ksi.[6] Angiotensiini I voi hajota neprilysiinillä (EC 3.4.24.11), tiometoligopeptidaasilla (EC 3.4.24.15) tai prolyyliendopeptidaasilla (EC 3.4.21.26) angiotensiiniksi (1–7). Angiotensiini I voi myös hajota glutamyyliaminopeptidaasilla angiotensiiniksi (2–10) tai angiotensiinikonvertaasi 2:lla (EC 3.4.17.23) angiotensiiniksi (1–9). Angiotensiini (1–9) hajoaa angiotensiinikonvertaasilla tai neprilysiinillä angiotensiiniksi (1–7).[7] Angiotensiini (1–7) voi dekarboksyloitua dekarboksylaasilla alamandiiniksi,[6] neprilysiinillä angiotensiiniksi (1–4) tai angiotensiinikonvertaasilla angiotensiiniksi (1–5). Angiotensiini II voi hajota angiotensiinikonvertaasi 2:lla tai prolyylikarboksipeptidaasilla (EC 3.4.16.2) angiotensiiniksi (1–7), joka käsitellään kuten edellä.[7]
Ihmisillä ainakin angiotensiini (1–9), angiotensiini (1–7) ja alamandiini sitoutuvat agonisteina (aktivoijina) AT2-, MAS1- ja MRGPRD-reseptoreihin. Sitoutuminen näihin muun muassa laajentaa suonia kumoten agiotensiinien II ja III supistavaa vaikutusta. Angiotensiini III tosin sitoutuu itsekin AT2-reseptoreihin aktivoivasti.[6]
Katso myös
Lähteet
- SE Thatcher et al: The renin-angiotensin-aldosterone system: methods and protocols. Humana Press, 2017. ISBN 9781493970308.
Viitteet
- L Jackson et al: Within the brain: the renin angiotensin system. International Journal of Molecular Sciences, 2018, 19. vsk, nro 3. PubMed:29543776. doi:10.3390/ijms19030876. ISSN 1422-0067. Artikkelin verkkoversio.
- A Cannavo et al: Aldosterone and mineralocorticoid receptor system in cardiovascular physiology and pathophysiology. Oxidative Medicine and Cellular Longevity, 2018. PubMed:30327709. doi:10.1155/2018/1204598. ISSN 1942-0900. Artikkelin verkkoversio.
- D Fournier et al: Emergence and evolution of the renin–angiotensin–aldosterone system. Journal of Molecular Medicine, 2012, 90. vsk, nro 5, s. 495–508. PubMed:22527880. doi:10.1007/s00109-012-0894-z. ISSN 0946-2716. Artikkelin verkkoversio.
- H Lu et al: Structure and functions of angiotensinogen. Hypertension Research, 2016-07, 39. vsk, nro 7, s. 492–500. PubMed:26888118. doi:10.1038/hr.2016.17. ISSN 0916-9636. Artikkelin verkkoversio.
- Angiotensinogen precursor uniprot.org.
- Thatcher, s. 175–186
- Thatcher, s. 190
- SR Vanga et al: Structural basis of inhibition of human insulin-regulated aminopeptidase (IRAP) by aryl sulfonamides. ACS Omega, 2018, nro 4, s. 4509–4521. PubMed:30023895. doi:10.1021/acsomega.8b00595. ISSN 2470-1343. Artikkelin verkkoversio.