Agonisti
Farmakologiassa agonistit ovat aineryhmä, joista kukin sitoutuu tiettyihin reseptoreihin aktivoivasti tai inaktivoivasti, jos ne ovat käänteisagonisteja.[1] Kyllin monen tietyntyyppisen reseptorin aktivointi johtaa eliössä lopulta reseptorien aktivaatiolle ominaisiin vaikutuksiin, kuten vaikkapa sydämen syketiheyden kasvuun.[2]

Antagonistit taas ovat aineita, jotka estävät agonistien aktivoivaa tai inaktivoivaa vaikutusta. Agonisteja ja antagonisteja sanotaan usein ligandeiksi. Kummatkin voivat olla sisäsyntyisiä tai eliön ulkopuolelta tulleita. Ne voivat muun muassa olla hormoneita, lääkkeitä tai välittäjäaineita.[2]
Luokittelu
Aineen sitoutumisherkkyyttä reseptoriin kuvaa affiniteetti. Pelkkä sitoutuminen ei riitä reseptorivasteen aikaansaantiin. Sitoutuneen aineen vasteen aiheuttamiskykyä kuvaa teho. Jos teho on nolla, aine ei ole agonisti vaan antagonisti. Jos aine lisää reseptorivastetta tai tuottaa päinvastaisen vasteen, aine on agonisti.[2]
Agonistien tehoa kuvaavat eri käsitteet:
- käänteisagonisti tuottaa reseptorissa inaktivoivan vasteen (vaste on alle 0 %). Eliöissä pieni osa reseptoreista voi olla aktiivisia, vaikka ne eivät sido agonistia – tämän perustason katsotaan vastaavan vastetta 0 %, vaikkei tämä siis pidä paikkaansa. Näiden perustason aktiivisten reseptorien vasteen estoon perustuu käänteisagonistien negatiivinen vaste. Esimerkki käänteisagonistista on spiperoni, jonka sitoutumiskohteena ovat serotoniinireseptorit.[2]
- osittaisagonisti aktivoi reseptorin vain osin (vaste on 0–100 %). Esimerkki on klonidiini, jonka kohteena ovat α-adrenergiset reseptorit.[2]
- täysagonisti aktivoi reseptorin lähes täysin (vaste noin 100 %). Esimerkki on fenyyliefriini, jonka kohteena ovat α-adrenergiset reseptorit.[2]
- superagonisti ylittää aktivaatiollaan reseptorin maksimivasteen (vaste on yli 100 %). Esimerkkejä ovat ibutamoreeni, jonka kohteena on greliinireseptori, ja taltireliini, jonka kohteena on TRHB-reseptori.[3]
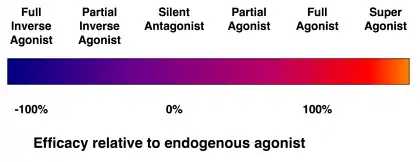
Agonismiin liittyy muitakin käsitteitä:[2]
- allosteerinen agonisti aiheuttaa vasteen, mutta sitoutuu reseptorissa johonkin muuhun paikkaan kuin mihin agonistit tyypillisesti sitoutuvat. Tyypillistä aluetta sanotaan ortosteeriseksi alueeksi.[4]
- koagonisti vaatii yhden tai usean muun agonistin eli koagonistin sitoutumisen reseptoriin vasteen aikaansaamiseksi. Koagonismissa kyse voi olla allosteerisesta sitoutumisesta.[4] Esimerkiksi L-glutamaatti ja L-glysiini tai D-seriini ovat toistensa koagonisteja NMDA-reseptorien aktivaatiossa.[5]
- suosiva agonismi (eng. biased agonism). Reseptori voi tuottaa usean vaikutuksen, kuten vaikutuksen A ja B. Suosivassa agonismissa vaikutusten teho vaihtelee sitoutuneesta agonistista riippuen: vaikutus A voi olla voimakkaampi kuin B, päinvastoin tai yhtä suuret, vaikka agonistien sitoutuminen tapahtuukin vain yhdenlaisiin reseptoreihin. Suosiva agonismi on ei ole harvinainen ilmiö ja sitä voidaan pitää farmakologiassa tärkeänä, mutta sen mittaaminen ja mallinnus voi olla hankalaa.[2]
- peruuttamaton eli irreversibeeli agonisti aktivoi reseptorin pysyvästi, eikä irtoa reseptorista. Sidos on usein kovalenttinen.[6] Esimerkki tästä on oksimorfatsoni, jonka sitoutumiskohteena ovat μ-opioidireseptorit.[7]
Teho

Reseptorien aktiivisuus voidaan mitata kokeellisesti. Saadaan kuvaaja, jossa agonistin aikaansaama vaste on konsentraation (in vitro) tai annoksen (in vivo) funktiona. Konsentraatio tai annos esitetään selkeyden takia logaritmisesti, jolloin saadaan hyperbelisen käyrän sijaan sigmoidinen käyrä (kuva).[2]
Agonistin aikaansaama maksimivaste eli Emax-arvo on kuvaajasta luettuna taso, jonka jälkeen agonistin teho ei kasva. Arvoa, joka on tästä puolet, kutsutaan EC50-arvoksi konsentraatioita käytettäessä ja ED50-arvoksi koe-eläimille tai -henkilöille annettuja annoksia käytettäessä. Edeltäviä arvoja käytetään farmakologiassa usein verrattaessa samavaikutteisten lääkkeiden tehoja toisiinsa.[2]
Katso myös
Lähteet
- RR Neubig et al: International Union of Pharmacology Committee on Receptor Nomenclature and Drug Classification. XXXVIII. Update on terms and symbols in quantitative pharmacology. Pharmacological Reviews, 2003, 55. vsk, nro 4, s. 597–606. PubMed:14657418. doi:10.1124/pr.55.4.4. ISSN 0031-6997. Artikkelin verkkoversio.
- HP Rang et al: Rang & Dale's pharmacology, s. 6-20. 8. painos. Elsevier, 2016. ISBN 9780702053627.
- R Schrage et al: Superagonism at G protein-coupled receptors and beyond. British Journal of Pharmacology, 2016, 173. vsk, nro 20, s. 3018–3027. PubMed:26276510. doi:10.1111/bph.13278. ISSN 1476-5381. Artikkelin verkkoversio. [vanhentunut linkki]
- TW Schwartz, B Holst: Allosteric enhancers, allosteric agonists and ago-allosteric modulators: where do they bind and how do they act? Trends in Pharmacological Sciences, 2007, 28. vsk, nro 8, s. 366–373. doi:10.1016/j.tips.2007.06.008. Artikkelin verkkoversio.
- K Hashimoto et al: The NMDA receptors, s. 6–8. Humana press, 2017. ISBN 9783319497952.
- S Pacifico et al: Urotensin-II peptidomimetic incorporating a non-reducible 1,5-triazole disulfide bond reveals a pseudo-irreversible covalent binding mechanism to the urotensin G-protein coupled receptor. Organic & Biomolecular Chemistry, 2017, 15. vsk, nro 21, s. 4704–4710. PubMed:28524918. doi:10.1039/C7OB00959C. Artikkelin verkkoversio.
- CL Williams et al: Irreversible opiate agonists and antagonists. IV. analgesic actions of 14-hydroxydihydromorphinone hydrazones. The Journal of Pharmacology and Experimental Therapeutics, 1988, 245. vsk, nro 1, s. 8–12. PubMed:2452249. ISSN 0022-3565. Artikkelin verkkoversio.
Aiheesta muualla
 Kuvia tai muita tiedostoja aiheesta Agonisti Wikimedia Commonsissa
Kuvia tai muita tiedostoja aiheesta Agonisti Wikimedia Commonsissa