Zink
Zinka elementu kimiko bat da, Zn ikurra eta 30 zenbaki atomikoa dituena. Zinka, nahiz eta zenbaitetan trantsizio-metal gisa sailkatu den, metala da. Bere taldeko beste elementuekin dituen antzekotasunez gain, magnesioaren eta berilioaren zenbait ezaugarri dauzka. Elementu hau urria da Lurrean, baina erraz erauzten da.
| Zinka | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 30 Kobrea ← Zinka → Galioa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ezaugarri orokorrak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izena, ikurra, zenbakia | Zinka, Zn, 30 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie kimikoa | trantsizio-metalak | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Taldea, periodoa, orbitala | 12, 4, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomikoa | 65,409(4) g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurazio elektronikoa | [Ar] 3d10 4s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroiak orbitaleko | 2, 8, 18, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietate fisikoak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egoera | solidoa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dentsitatea | (0 °C, 101,325 kPa) 7138 g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Urtze-puntua | 692,68 K (419,53 °C, 787,15 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Irakite-puntua | 1.180 K (907 °C, 1.665 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Urtze-entalpia | 7,32 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lurrun-presioa
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietate atomikoak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristal-egitura | hexagonala | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidazio-zenbakia(k) | 3 , 2 (oxido anfoterikoa) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatibotasuna | 1,65 (Paulingen eskala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizazio-potentziala | 1.a: 906,4 kJ/mol 2.a: 1.733,3 kJ/mol 3.a: 3.833 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio atomikoa (batezbestekoa) | 135 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio atomikoa (kalkulatua) | 142 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio kobalentea | 131 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsen erradioa | 139 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Datu gehiago | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eroankortasun termikoa | (300 K) 116 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soinuaren abiadura | 3.850 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopo egonkorrenak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Zinkaren isotopoak
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Letoia, kobre eta zink proportzio ezberdinez osaturiko nahastura bat, K.a. hirugarren milurtekoan erabiltzen zen Egeon, Iraken, Arabiar Emirerri Batuetan, Kalmukian, Turkmenistanen eta Georgian eta K.a. bigarren milurtekoan Mendebaldeko Indian, Uzbekistanen, Iranen, Sirian eta Israelen.[1][2] Zink metala Indian XII. mendean hasi zen eskala handian produzitzen, nahiz eta antzinako erromatarrek eta greziarrek ezagutzen zuten.[3] Rajastaneko meatzeek zinkaren ekoizpena K.a. VI. mendean ematen zela frogatu dute.[4] Gaur egun, zinka puruaren frogarik zaharrena Zawarren (Rajasthan) aurkitutakoa da, K.a. IX. mendekoa. Zink purua erauzteko destilazio prozesu bat erabiltzen zen.[5] Alkimistek zinka erretzen zuten airean "filosofoen artilea" edo "elur zuria" deitzen zutena sortzeko.
Elementu hau ziurrenik Parazeltso alkimistak izendatu zuen alemanezko zinke hitzean oinarritua (arantza, hortza). Andreas Sigismund Marggraf aleman kimikariari esleitzen zaio 1746. urtean zink metaliko puruaren aurkikuntza. Luigi Galvani eta Alessandro Voltak zinkaren propietate elektrokimikoak aurkitu zituzten 1800. urtean. Korrosioaren aurka burdina galbanizatzea da (galbanizazio beroa) zinkaren aplikazio nagusia. Beste aplikazio batzuk bateria elektrikoak, pieza txiki ez-egiturazkoen galdaketa eta letoia bezalako meta-nahasturak dira. Zinkaren konposatu ugari erabiltzen dira, hala nola zink karbonatoa eta zinka glukonatoa (osagarri dietetikoak), zink kloruroa (desodoranteak), zink piriotinea (zahiaren aurkako xanpuak), zink sulfuroa (pintura lumineszenteetan) eta zinka metil edo zink dietila laborategi organikoetan.
Zinka funtsezko mineral bat da, jaioberrien eta ondorengo garapenaren barne.[6] Zink gabeziak bi mila milioi pertsona ingururi eragiten dio eta gaixotasun askori lotuta dago.[7] Haurretan, gabeziak hazkunde atzerapena, heltze sexualaren atzerapena, infekzio suszeptibilitatea eta beherakoa eragiten ditu.[6] Zentro erreaktiboan zink atomoak dituzten entzimak oso zabalduta daude biokimikan, hala nola, alkoholaren deshidrogenasa gizakietan.[8] Zinkaren gehiegizko kontsumoak ataxia, letargia eta kobre gabezia sor ditzake.
Ezaugarri nagusiak
Metal zuri urdinxka da, airean erretzen denean gar berde urdinxka igortzen duena. Aire lehorrak ez dio erasaten, baina hezetasuna badago oxidozko edo karbonato basikozko gainazala sortzen zaio, metala isolatuz eta korrosiotik babestuz.
Metal honek erresistentzia handia dauka deformazio plastikoaren aurrean. Tenperatura igo ahala, erresistentzia murriztu egiten da; hain zuzen, zink-xaflak sortzeko 100 °C-etik gora egin behar da lan. Ezin da garraztasun bidez gogortu eta giro-tenperaturan isurpen-fenomenoa jasaten du (gainerako metal eta metal-nahastura gehienek ez bezala) eta karga txikiek deformazio ez iraunkorrak eragiten dituzte.
Propietate fisikoak
Zinka metal urdin-zuri, distiratsu eta diamagnetikoa da[9], metalaren ohiko erabilera komertzialek akabera matea duten arren.[10] Burdinak baino dentsitate zerbait baxuagoa eta kristal-egitura hexagonal bat du, atomo bakoitzak sei auzokide hurbilenak 265,9 pm-etan bere planoan eta beste sei distantzia handiagora 290,6 pm-tara dituelarik.[11] Metal gogorra eta hauskorra izaten da tenperatura gehienetan, baina 100 eta 150 °C artean malgua bihurtzen da.[9][10] 210 ° C gainetik, metala hauskorra bihurtzen da berriro, eta irabiatuz haustu daiteke.[12] Zinka elektrizitatearen eroale ona da.[9] Metal bat izateko, zinkak urtze (419,5 ° C) eta irakite-puntu (907 ° C) erlatiboki baxuak ditu.[13] Fusio puntua d blokeko metal guztien artean txikiena da merkurioaren eta kadmioaren ostean. Horregatik, besteak beste, zinka, kadmioa eta merkurioa sarritan ez dira d-blokeko gainontzeko metalen antzera trantsizio-metal kontsideratzen.[13]
Metal-nahastura askok zinka dute, letoia barne. Zinkarekin nahastura bitarrak sortzen dituzten beste metalak aluminioa, antimonioa, bismutoa, urrea, burdina, beruna, merkurioa, zilarra, magnesioa, kobaltoa, nikela, telurioa eta sodioa dira.[14] Zinka edo zirkonioa ferromagnetikoak ez diren arren, haien ZrZn2 nahasturak ferromagnetismoa du 35 K azpitik.[9] Zink barra batek soinu bereizgarria sortzen du tolestean, eztainuaren antzera.
Ugaritasuna
Zinkak Lurraren lurrazaleko 75 ppm inguru (% 0,0075) osatzen du, eta 24. elementu ugariena da. Lurzoruak 5-770 ppm zink du, batez bestekoa 64 ppm delarik. Itsasoko urek 30 ppb baino ez dute eta atmosferak, 0,1-4 μg / m3.[15] Orokorrean beste oinarrizko metal batzuekin batera aurkitu ohi da meatan, hala nola, kobrea eta beruna.[16] Zinka kalkofilo bat da. Honek esan nahi du elementu hau mineraletan sufre eta beste kalkogeno astunago batzuekin batera aurkitzea errazagoa dela, oxigeno edo kalkogenoak ez diren halogenoekin baino. Sulfuroak lurrazala solidifikatzen joan zen heinean sortu ziren, Lurreko hasierako atmosferak eragindako erredox erreakzioen pean.[17] Esfalerita, zink sulfuro mota bat, zinka lortzeko gehien meatzen den mea da, bere zink kontzentrazioa % 60-62 artekoa izaten delako.[16]
Zinka lortzeko meatzen diren beste mineral honako hauek dira: smithsonita (zink karbonatoa), hemimorfita (zink silikatoa), wurtzita (beste zink sulfuro bat) eta, batzuetan, hidrazitina (oinarrizko zink karbonatoa).[15] Wurtzita izan ezik, beste mineral guztiak zink sulfuro primitiboen meteorizazioaren ondorioz sortu ziren.[17]
Ezagutzen diren munduko zink baliabideak 1,9-2,8 mila milioi tona ingurukoak dira.[18][19] Gordailu handiak Australia, Kanada eta Estatu Batuetan daude, eta Iranen berriz erreserbarik handienak.[17][20][21] Zinkaren oinarrizko erreserbaren azken estimazioa (gaur egungo meatzaritza eta ekoizpen praktikekin lotutako gutxieneko irizpide fisikoekin bat datorrena) 2009. urtean egin zen eta gutxi gorabehera 480 miloi tona zirela kalkulatu zen.[22] 346 milioi tona inguru meatu dira historia osoan zehar 2002ra arte, eta adituek 109-305 milioi tona erabiltzen ari direla estimatzen dute.[23][24][25]
Isotopoak

Zinkaren bost isotopo existitzen dira naturan. 64Zn isotopoa da ugariena (% 48,63 ugaritasun naturala).[26] Isotopo honek hain semidesintegrazio-periodo luzea du, 4.3 x 1018 urtekoa,[9] bere erradioaktibitatea alde batera utzi daitekeela.[27] Era berean, 70Zn (% 0,6), 1.3 x 1016 urte bitarteko semidesintegrazio-periodoa duena, ez da erradioaktiboa kontsideratzen. Naturan aurkitzen diren gainerako isotopoak 66Zn (% 28), 67Zn (% 4) eta 68Zn (% 19) dira.
Hainbat dozena isotopo erradioaktibo kategorizatu dira. 65Zn, 243,66 eguneko semidesintegrazio-periodoarekin, aktibotasun gutxien duen erradioisotopoa da, hurrengoa 72ZN izanik, 46,5 orduko semidesintegrazio-periodoarekin.[26] Zinkak 10 isomero nuklear ditu. 69mZn isomeroak semidesintegrazio-periodo handiena du, 13,76 ordu.[26] Goi indizeko m hizkiak isotopo metaegonkorra dela adierazten du. Isotopo metaegonkor baten nukleoa kitzikatutako egoeran dago eta oinarrizko egoerara itzuliko da gamma izpi formako fotoi bat igorriz. 61Zn isomeroak kitzikatutako hiru egoera metaegonkor ditu eta 73Zn-k bi ditu.[28] 65Zn, 71Zn, 77Zn eta 78Zn isotopoek kitzikatutako egoera metaegonkor bat baino ez dute.[26]
Masa zenbakia 66 baino txikiagoa duen zinkaren erradioisotopo baten desintegrazio modurik arruntena elektroi-harrapaketa da. Elektroi-harrapaketaren ondorio den desintegrazioaren produktua kobrearen isotopo bat da. 66 masa zenbakia baino altuagoa duten zinkaren erradioisotopoen desintegrazio modu arruntena berriz, beta desintegrazioa (β−) da, galioaren isotopo bat sortzen duena.[26]
Konposatuak eta kimika
Erreaktibotasuna
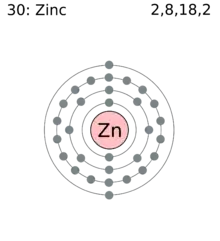
Zinkaren konfigurazio elektronikoa [Ar]3d104s2 da eta taula periodikoaren 12. taldeko kide da. Neurrizko erreaktibotasuna duen metala da eta agente murriztaile sendoa.[9] Metal puruaren gainazalak azkar galtzen du distira, azkenean babesten duen oinarrizko zink karbonato (Zn5(OH)6(CO3)2 geruza bat osatuz, atmosferako karbono dioxidoarekin erreakzionatuz.[29] Geruza honek airearekin eta urarekin gehiago ez erreakzionatzen laguntzen du.
Zinka erretzean, gar berde-urdina eta distiratsua sortzen da, zink oxido kea sortzen duena.[30] Zinkak erraz erreakzionatzen du azidoekin, alkaliekin eta beste ez-metalekin.[31] Oso purua den zinkak, giro tenperaturan, soilik azidoekin eta motel erreakzionatzen du.[30] Azido gogorrek, esate baterako, azido klorhidriko edo sulfurikoak, gainazaleko geruza erauz dezakete eta ondorengo erreakzioak, urarekin, hidrogenoaren gasa askatzen du.[30]
Zinkaren kimikan +2 oxidazio egoera nagusi da. Oxidazio-egoera horretan konposatuak sortzen direnean, kanpoko geruzako s elektroiak galdu egiten dira, konfigurazio elektronikoa [Ar]3d10 duen ioia emanez.[32] Soluzio urtsuetan, oktaedro itxurako konposatu bat [Zn(H2O)6]2+ da espezie nagusia.[33] Zinka zink kloruroarekin batera lurruntzeak, 285 ° C-tik gorako tenperaturetan, Zn2Cl2 eratzen du, +1 oxidazio-egoera duen zink konposatu bat.[30] Ez dira zinkaren konposaturik ezagutzen +1 edo +2 oxidazio egoera ez dutenak.[34] Kalkuluek adierazten dute +4 oxidazio egoera duen zink konposatu bat existitzea oso zaila dela.[35]
Zinkaren kimika lehen lerroko trantsizioko metalen, nikelaren eta kobrearen, kimikaren antzekoa da, nahiz eta betetako d-geruza bat duen eta konposatuak diamagnetikoak eta, orokorrean, kolorerik gabeak diren.[17] Zink eta magnesioaren erradio ionikoak ia berdinak dira. Horregatik, gatz baliokideek kristal egitura bera dute[9], eta erradio ionikoa faktore erabakigarri bat den beste kasuetan, zinkaren kimikak antz handia du magnesioarenarekin.[30] Beste alderdi batzuetan, lehenengo lerroko trantsizioko metalen antzekotasun gutxi dago. Zinkak N- eta S- emaileekin kobalentzia handiagoko eta konplexu egonkorragoak diren zubiak osatzen ditu.[17]
Zink(I) konposatuak

Zink(I) konposatuak arraroak dira eta oxidazio egoera baxua egonkortzeko ligand handiak behar dituzte. Zink(I) konposatu gehienek formalki [Zn2]2+ nukleoa dute, [Hg2]2+ katioi dimerialaren antzekoa dena, merkurio(I) konposatuetan agertzen dena. Ioiaren izaera diamagnetikoak egitura dimerikoa berretsi egiten du. Zn-Zn lotura duen lehen zink(I) konposatua, (η5-C5Me5)2Zn2, lehen dimetalozenoa da ere. [Zn2]2+ ioia azkar zink metalera eta zink(II) ioira deskonposatzen da, eta oso egoera konkretuetan lortu da soilik.[36]
Zink(II) konposatuak

Zinkaren konposatu bitarrak metaloide eta gas nobleak ez diren ez-metal gehienentzat ezagutzen dira. ZnO oxidoa soluzio urtsu neutroetan ia disolbaezina den hauts zuria da, baina anfoterikoa da, indartsuak diren soluzio basiko eta azidoetan disolbatzen baita.[30] Beste kalkogenoek (ZnS, ZnSe eta ZnTe) elektronika eta optikan aplikazio askotarikoak dituzte.[37] Pniktogenoak (Zn3N2, Zn3P2, Zn3As2 eta Zn3Sb2),[38][39] peroxidoa (ZnO2), hidruroa (ZnH2) eta karburoa (ZnC2) ere ezagutzen dira.[40] Lau haluroen artean, ZnF2k du izaera ionikoena, beste batzuek (ZnCl2, ZnBr2 eta ZnI2) urtze puntu nahiko baxuak dituzte eta kobalenteen antz handiagoa dutela esan ohi da.[17]
Zn2+ ioiak dituzten soluzio basiko ahuletan, Zn(OH)2 hidroxidoa prezipitatu zuri gisa sortzen da. Soluzio alkalino indartsuagoetan, hidroxidoa disolbatu egiten da zinkatinak osatzeko ([Zn(OH)4]2-).[17] Zn(NO3)2 nitratoa, Zn(ClO3)2 kloratoa, ZnSO4 sulfatoa, Zn3(PO4)2 fosfatoa, ZnMoO4 molibdatoa, Zn(CN)2 zianuroa, Zn(AsO4)2·8H2O arsenatoa eta ZnCrO4 kromatoa (kolorea duen zinkaren konposatu bakanetako bat) zinkaren beste konposatu ez-organikoen adibide batzuk dira.[41][42] Zinkaren konposatu organiko baten adibide errazena azetatoa da (Zn(O2CCH3)2).
Historia
Antzinako erabilera

Antzinako garaietako zink ez-puruaren erabilerari buruzko zenbait adibide isolatu aurkitu dira. Zink meak zink-kobre nahasturazko letoia egiteko erabiltzen ziren zinka elementu isolatu gisa aurkitu baino milaka urte lehenago. K.a. XIV. mende eta X. mende bitarteko letoi judearrak % 23 zinka du.[17]
Letoia egiteko jakituria antzinako Greziara hedatu zen K.a. VII. mendean, baina gutxi erabili zen.[2] % 80-90 zink duten metal-nahasturaz (falta den ehunekoa berun, burdina, antimonio eta beste metalez osatua) eginiko apaingarriak aurkitu dira, duela 2.500 urtekoak.[16] % 87,5 zinka duen estatuatxo bat aurkitu zen daziar aztarnategi batean, ziurrenik historiaurrekoa dena.[43]
Ezagutzen diren pilula zaharrenak zink karbonatoak erabiliz eginak dira, hidrozinzita eta smithsonita. Pilulak mindutako begientzat erabiltzen ziren eta Relitto del Pozzino erromatar ontzian aurkitu ziren, K.a. 140 urtean hondoratu zena.[44][45]
Letoiaren fabrikazioa erromatarrek K.a. 30. urterako ezagutzen zuten.[15] Letoia egiteko kalamina hautsa (zink silikato edo karbonatoa), ikatza eta kobrea elkarrekin arragoa batean berotuz egiten zuten.[15] Ondoren, kalamina letoia moldatzen zuten armak egiteko erabiltzeko.[46] Erromatarrek garai kristauan egindako txanpon batzuk ziurrenik kalamina letoizkoak dira.[47]
Estrabonek K.a. I. mendean (baina K.a. IV. mendeko Teoponpo historialariaren lana aipatuz, orain galdutakoa) "gezurrezko zilar tantak" aipatzen ditu, kobrearekin nahastean letoia sortzen dutenak. Erreferentzia hau zink kantitate txikiei buruzkoa izan daiteke, sulfuro meak galdatzean sortutako hondakina.[48] Era honetan lortutako zinka askotan baztertu egiten zen, baliogabekoa zelakoan.[43]
Berne zink taula zinkaren nahastura batez eginiko pieza bat da, Galia erromatar garaikoa.[49]
Charaka Samhita testuak, 300 eta 500 urteen bitartean idatzi zela uste denak[50], metal bat aipatzen du, oxidatzerakoan pushpanjan deiturikoa sortzen duena. Zink oxidoa dela uste da.[48] Zawarko zink meatzeak, Udaipurretik gertu, Mauryar arotik aktiboak izan dira. Bertan zink metalaren galdaketa, ordea, XII. mende inguruan hasi zela dirudi.[51][52] Estimazio baten arabera, kokapen honetan milioi bat tona zink metaliko eta zink oxido sortu ziren XII eta XVI mendeen artean.[15] Beste estimazio batek 60.000 tona zink metalikoa ekoitzi zirela dio, garai berdinean.[51] Rasaratna Samuccaya testuak, XIII. mendean idatzia, zinka zuten bi motatako meak aipatzen ditu: bat metala erauzteko erabiltzen zena eta beste bat eta helburu sendagarrietarako erabiltzen zena.[53]
Hasierako ikerketak eta izendatzea
Madanapala (Taka dinastia) hindu erregearen medikuntza Lexiconean, zinka Yasada edo Jasada izendapena zuen metal gisa jasotzen zen. 1374. urte inguruan idatzi zen.[54] Kalamina artilea eta beste substantzia organikoak erabiliz erredukzionatuta zink ez-puruaren galdaketa eta erauzketa XIII. mendean lortu zen Indian.[9][55] Txinatarrek ez zuten teknika hau ikasi XVII. mendera arte.[55]
.svg.png.webp)
Alkimistek zink metala airean erretzen zuten eta kondentsadore bat erabiliz sortzen zen zink oxidoa biltzen zuten. Zenbait alkimistek zink oxido honi lana philosophica deitzen zioten, "filosofoaren artilea" esan nahi duena latinez. Artile itsurako xerloak zirelako eman zioten izen hori, nahiz eta beste batzuentzat elur zuria zirudien eta nix album izena ematen zioten.[56]
Metalaren izena seguruenik Parazeltsok dokumentatu zuen lehenik, Suitzan jaiotako alkimista alemaniarrak. Metalari zinkum edo zinken deitu zion bere Liber Mineralium II liburuan, XVI. mendean.[57][55] Hitza alemanezko zinke hitzetik eratorria da ziurrenik, eta ustez "hortz-itxurakoa edo zorrotza" esan nahi zuen (zink metalezko kristalek orratz itxura dute).[58] Baliteke baita ere zink hitzak "eztainu itxurako" esan nahi izatea, eztainua alemanez zinn esaten baita.[59] Beste aukera bat ere bada: سنگ seng persierazko hitzetik eratorria izatea, harria esanahia duena.[60]
Andreas Libavius alemaniarrak 1596. urtean portugaldarrei harrapatutako merkantzia-ontzi batetik "calay" izendatu zuen produktu baten kantitate bat jaso zuen.[61] Libaviusek laginaren propietateak deskribatu zituen, zinka izan zitekeelarik. Zinka Europara Ekialdetik inportatzen zen erregularki XVII. mendean eta XVIII. mendearen hasieran[55], baina batzuetan oso garestia zen.
Isolazioa

Zink metalikoa Indian 1300. urtean isolatu zen[62][63][64], Mendebaldean baino askoz lehenago. Europan isolatu aurretik, Indiatik inportatu zen 1600. urte inguruan.[65] Postlewayten Universal Dictionaryk, Europako informazio teknologikoa ematen duen iturri garaikideak, ez zuen zinka 1751 baino lehenago aipatzen, baina elementua lehenago ikertu zen.[53][66]
P. M. de Respour alkimista flandiarrak zink oxidotik zink metalikoa erauzi zuela jakinarazi zuen 1668an.[15] XVIII. mendearen hasieran, Étienne François Geoffroyk deskribatu zuen nola zink oxidoa kristal horietan kondentsatzen den, galdatzen ari den zink mea gainean jarritako burdin barretan.[15] Britainia Handian, John Lanek zinka galdatzeko esperimentuak egin zituztela esaten da. Ziurrenik Landoren egin zituen, bere 1726ko porrotaren aurretik.[67]
Britainia Handian 1738an, William Championek kalaminatik zinka erauzteko prozesu bat patentatu zuen.[68] Bere teknika Rajastaneko zink meatzetan erabiltzen zenaren antzekoa zen, baina ez dirudi zonalde hori bisitatu zuenik.[65] Championen prozesua 1851. urteraino erabili zen.[55]
Andreas Marggraf kimikari alemaniarra hartzen da zink metal purua isolatu zuen lehen pertsona gisa, nahiz eta Anton von Swab kimikari suediarrak kalaminatik zinka destilatu zuen lau urte lehenago.[55] Bere 1746ko esperimentuan, Marggrafek kalamina eta ikatz nahasketa bat berotu zuen itxitako ontzi batean, kobrerik gabe, metal bat lortzeko.[43] Prozedura hau komertzialki praktikoa bihurtu zen 1752. urterako.[10]
Ondorengo lanak
.jpg.webp)
William Champion anaiak, Johnek, zink sulfitoa kaltzinatzeko prozesu bat patentatu zuen 1758an. Prozesu honetan oxido bat sortzen zen, gero erretorta prozesuan erabili ahal zena.[16] Honen aurretik, zinka ekoizteko soilik kalamina erabiltzen zen. 1798an, Johann Christian Rubergek galdaketa prozesua hobetu zuen, lehen galdatze erretorta horizontala eraikiz.[69] Jean-Jacques Daniel Donyk antzeko makina bat eraiki zuen Belgikan, zink gehiago prozesatzen zuena.[55] Luigi Galvani mediku italiarrak 1780an aurkikuntza garrantzitsua egin zuen: berriki disekatutako igel baten bizkarrezur-muina burdin barra bati letoizko kako batez lotzerakoan, igelaren hanka uzkurtu egiten zen.[70] Era oker batean, nerbio eta muskuluek elektrizitatea sortzeko modu bat aurkitu zuela pentsatu zuen eta efektuari “animalien elektrizitatea” deitu zion.[71] Gelaxka galbanikoa eta galbanizazio prozesua Luigi Galvaniren omenez izendatu ziren, eta bere aurkikuntzek bateria elektrikoetarako, galbanizazioetarako eta babes katodikoetarako bidea ireki zuten.[71]
Galvaniren lagun Alessandro Voltak efektua ikertzen jarraitu zuen eta pila voltaikoa asmatu zuen 1800. urtean.[70] Voltaren pilaren oinarrizko unitatea gelaxka galbaniko sinplifikatua zen: kobre eta zink plakak elektrolito batez bereiziak eta eroale bati kanpotik konektatuta. Unitateak serialki pilatuta zeuden, zelula voltaikoa egiteko. Elektrizitatea ekoizteko, elektroiak zinketik kobrera zuzentzen ziren eta zinka jatea ahalbidetuz.[70]
Zinkaren izaera ez-magnetikoak eta soluzioetan kolorerik ez izateak, biokimikan eta elikaduran zuen garrantziaren aurkikuntza atzeratu zuten.[72] Hau 1940. urtean aldatu zen, anhidrasa karbonikoak, karbono dioxidoa odoletik ateratzen duen entzima batek, bere gune aktiboan zinka zuela ikusi zenean.[72] Karboxipeptidasa entzima digestiboa zinka zuen bigarren entzima ezaguna bihurtu zen 1955ean.[72]
Produkzioa
Meatzaritza eta tratamendua
| Postua | Herrialdea | Tonak |
|---|---|---|
| 1 | 5,000,000 | |
| 2 | 1,500,000 | |
| 3 | 1,300,000 | |
| 4 | 820,000 | |
| 5 | 700,000 | |
| 6 | 700,000 |

Zinka laugarren metal erabiliena da, burdina, aluminioa eta kobrearen atzetik. 13 milioi tona inguru ekoizten dira urtero.[18] Munduko zink ekoizle handiena Nyrstar da, Australiako OZ Minerals eta Belgikako Umicore enpresen elkarketatik sortua.[74] Munduko zinkaren % 70a meatzaritzatik lortzen da, gainerako % 30a zinka birziklatzetik dator.[75] Komertzialki purua den zinka Goi Maila Berezi bezala ezagutzen da (ingelesez, Special High Grade edo SHG), eta % 99.995eko purutasuna du.[76]
Mundu mailan, zink berriaren % 95 sulfuro mea gordailuetatik ateratzen da, eta horietan esfalerita (ZnS) kobre, berun eta burdin sulfuroekin nahastua egoten da ia beti.[77] Zink minak mundu osoan zehar sakabanatuta daude, Txina, Australia eta Perun daudelarik eremu nagusiak. Txinak 2014. urtean munudko zink ekoizpenaren % 38 ekoiztu zen.[22]
Zink metala meatzaritza erabiliz produzitzen da.[78] Mea fin-fin birrindu egiten da; ondoren, flotazio prozesuan sartzen da mineralak gangatik bereizteko (hidrofobizitatearen propietatean oinarrituta), zink sulfuro mea kontzentratu bat lortzeko.[78] Ore honek % 50a zinka, % 32 sufrea, % 13 burdina eta % 5 SiO2 du.[78]
Txigortzeak zink sulfuro kontzentratuta zink oxido bihurtzen du:[77]
- 2 ZnS + 3 O
2 → 2 ZnO + 2 SO
2
Sufre dioxidoa azido sulfurikoa ekoizteko erabiltzen da, lixibiatzeko prozesurako beharrezkoa dena. Zink karbonatoa edo zink silikatoa (Namibiako Skorpion Gordailuan adibidez) erabiltzen badira zinkaren ekoizpenean, txigortzea alde batera utzi daiteke.[79]

Ekoizpenean jarraitzeko bi oinarrizko metodo erabiltzen dira: pirometalurgia edo elektrohigadura. Pirometalurgiak zink oxido karbono edo karbono monoxidoan erreduzitzen du 950 °Cko tenperaturan metalera. Zink lurrun bezala destilatzen da beste metaletatik banatzeko, tenperatura horietan lurruntzen ez direnak.[80] Zink lurruna kondentsadore batean biltzen da.[77] Ondorengo ekuazioek prozesu hau deskribatzen dute:[77]
- 2 ZnO + C → 2 Zn + CO
2 - ZnO + CO → Zn + CO
2
Elektrohigaduran, zinka azido sulfurikoaren bidez lixibiatzen da meatik:[81]
- ZnO + H
2SO
4 → ZnSO
4 + H
2O

Azkenik, zinka elektrolisi bidez erreduzitzen da.[77]
- 2 ZnSO
4 + 2 H
2O → 2 Zn + 2 H
2SO
4 + O
2
Azido sulfurikoa berreskuratzen eta birziklatu egiten da lixibiatze prozesuan berrerabiltzeko.
Galbanizatutako lehengai arku elektrikozko labe batera botatzen denean, zinka hautsetik berreskuratzen da hainbat prozesu bidez, batez ere Waelz prozesua (2014ean, % 90).[82]
Ingurugiroan eragina
Zink sulfuriko duten meak birfintzean, sufre dioxidoaren eta kadmio lurrun bolumen handiak sortzen diru. Galdaketa zepek eta beste hondakinek metal kantitate handiak dituzte. 1,1 miloi tona zink metaliko eta 130 mila tona berun inguru meatu eta galdatu ziren La Calamine eta Plombières belgikar herrietan 1806 eta 1882 bitartean.[83] Iraganeko meatzaritza-operazioek zinka eta kadmioa askatzen dute, eta Geul ibaiaren sedimentuak metal kantitate handiak dituzte.[83] Duela bi mila urte inguru, meatzaritza eta galdaketaren eraginez sortutako zink emisioak urtean 10 mila tona inguru ziren. 1850. hamarkadatik aurrera 10 bider handitu ondoren, zink emisioak urtean 3.4 milioi tona izatera iritsi ziren 80.ko hamarkadan. 1990eko hamarkadan, 2,7 miloi tonetara jaitsi ziren. Hala ere, 2005. urtean Artikoko troposferari buruz egindako ikerketa batek erakutsi zuen bertako kontzentrazioek ez zutela gainbehera islatzen. Emisio antropogeno eta naturalen arteko ratioa 20-1ekoa da.[84]
Industria eta meatzaritza eremuetatik igarotzen diren ibaietan zink kontzentrazioa 20 ppm-koa izan daiteke.[15] Hondakin tratamendu eraginkorrak asko murrizten ditu kopuru hauek: Rhin ibaian egindako tratamenduak, esate baterako, zinkaren maila 50 ppb-ra jaitsi du.[15] Kutsadura honek eraginak izan ditzake: kontzentrazioak 2 ppm-ra iristen badira, arrainek odolean eraman dezaketen oxigenoaren kantitatean eragiten du.[85]

Zinkaren meatzaritzak, birfintzeak edota zinka duten lohiekin lurra fertilizatzeak lurrak kutsatzen ditu. Lur kilo lehor bakoitzeko hainbat zink gramo izatera iritsi daitezke. 500 ppm baino gehiago dituzten lurretan, landareek beste ezinbesteko metal batzuk (hala nola, burdina eta manganesoa) xurgatzeko duten gaitasuna kaltetu egiten da. 2000 ppm-tik 180.000 ppm-rako (% 18) zink mailak erregistratu dira lurzoru lagin batzuetan.[15]
Aplikazioak
Zinkaren aplikazio nagusiak (AEBetako portzentaiak dira)[90]
- Galbanizazioa (% 55)
- Letoia eta brontzea (% 16)
- Beste nahasturak (% 21)
- Hainbat (% 8)
Korrosioaren aurkako babesa eta bateriak

Zinka korrosioaren aurkako agente gisa erabiltzen da gehien[17], eta galbanizazioa (burdina edo altzairuaren estaldura) forma ezagunena da. 2009an, Ameriketako Estatu Batuetan, erabilitako zink metalaren % 55a edo 893.000 tona, galbanizaziorako erabili ziren.[90]
Zinka burdina edo altzairua baino erreaktiboagoa da eta, beraz, tokiko oxidazio ia guztiak erakartzen ditu, korrosioak guztiz jaten duen arte.[91] Oxido eta karbonatozko (Zn5(OH)6(CO3)2) babes geruza bat sortzen da gainazalean, zinkak korrosioa jasaten duen heinean.[16] Babes honek zink geruza urratzen denean ere irauten du, baina degradatzen joaten da zinkak korrosioa jasaten duen heinean.[16] Zinka elektrokimikoki aplikatzen da edo urtutako zink moduan, urtze-galbanizazioaz edota lainoztatzeaz. Galbanizazioa kate lotura hesietan, babes barandetan, esekidura-zubietan, argiztapenetan, metalezko teilatuetan eta autoen gorputzetan erabiltzen da.[15]
Zinkaren erreaktibotasun erlatiboak eta bere oxidazioa erakartzeko gaitasunak babes katodikoan (BK) erabiltzeko babes anodo eraginkorra egiten du. Esate baterako, lurperatutako kanalizazio baten babes katodikoa zinkarekin egindako anodoak kanalizaziora konektatzen lortzen da.[16] Zinkak anodo gisa jokatzen du (negatiboa den bornea), pixkanaka korrosioa jasanez korronte elektrikoa altzairuzko kanalizaziora igortzen duen bitartean.[16] Zinka itsasoko uren esposizioa jasaten duten metalak katodikoki babesteko ere erabiltzen da.[92] Zink disko bat itsasontzi baten burdinazko lemari atxikitzen bazaio, astiro jasango du korrosioa lema oso-osorik mantentzen diren bitartean.[91] Era berean, helize bati edo gilaren metalezko babesari atxikitako zink estalki batek aldi baterako babesa eskaintzen du.
-0.76 volteko oinarrizko elektrodo potentzialarekin, zinka baterientzako anodo material gisa erabiltzen da (erreaktiboagoa den litioa (SEP -3.04 V) litiozko baterien anodoentzat erabiltzen da). Zink hautsa era honetan erabiltzen da bateria alkalinoetan eta zink-karbono baterietako zorroa (anodo gisa funtzionatzen duena era berean) zink xafla batez osatua dago.[93][94] Zinka zink-aire bateriaren anodo edo erregai gisa ere erabiltzen da.[95][96][97] Zink-zerio erredox fluxu-bateriak ere zinkean oinarritutako erdi-zelula negatiboetan oinarritzen dira.[98]
Nahasturak
Oso erabilia den zink-nahastura bat letoia da. Nahastura honetan kobrea % 3 eta % 45 arteko edozein zink kopururekin aleatzen da, letoi motaren arabera.[16] Letoia oro har, kobrea baino harikorragoa eta duktilagoa da, eta korrosioarekiko erresistentzia handiagoa du.[16] Propietate hauek erabilgarria egiten dute komunikazio ekipamendu, hardware, musika tresna eta ur-balbuletan.[16]

Asko erabiltzen diren beste zink-nahastura batzuk, nikel zilarra, aluminio soldadura eta brontze komertziala dira.[9] Zinka kanalizazio garaikideetan ere erabiltzen da, tradizionalki erabilitako berun/eztainu nahasturaren ordez.[99] % 85-88 zinka, % 4-10 kobrea eta % 2-8 aluminioa duten nahasturek makina-errodamendu mota batzuetan erabilera mugatua dute. Zinka AEBtako zentimo bateko txanponetako metal nagusia da 1982tik.[100] Zink nukleoa kobrezko geruza mehe batez estalita dago, kobrezko txanpon baten itxura emateko. 1994. urtean, 33.200 tona zink erabili ziren Ameriketako Estatu Batuetan 13,6 mila milioi txanpon ekoizteko.[101]
Kobrea, aluminioa eta magnesioa kantitate txikietan duten nahasturak erabilgarriak dira hainbat galdaketa motatarako, bereziki automobilgintza, elektrizitate eta hardware industrietan.[9] Zamak izenarekin merkaturatzen dira metal-nahastura hauek.[102] Honen adibide bat zink aluminioa da. Bere urtze puntu baxuak, bere biskositate baxuarekin bat, forma txiki eta korapilatuak ekoizteko aukera ematen du. Laneko tenperatura baxuak galdaketa produktuen hozte azkarra dakar, eta honek muntai ekoizpen azkarrak.[9][103] Beste nahastura batek, Prestal izenarekin merkaturatzen denak, % 78 zink eta % 22 aluminioa dauka, eta altzairua bezain sendoa, baina plastikoa bezain malgua dela esaten da.[9][104] Nahastura honen superplastizitate horri esker, zeramika eta zementuarekin egindako moldeetan galdatzea ahalbidetzen du.[9]
Antzeko metal-nahasturak, berun-kopuru txiki bat gehituta, hoztutakoan xafla gisa biribildu daitezke. % 96 zinka eta % 4 aluminioa duen nahastura bat trokelak egiteko erabiltzen da, metalezko moldeak garestiegiak liratekeen produkzioetarako.[105] Fatxada, teilatu, eta xafla estrukturako beste aplikazio batzuetarako, titanioa eta kobrea duten zink nahasturak erabiltzen dira.[106] Aleatu gabeko zinka hauskorregia da fabrikazio prozesu hauetarako.[106]
Material trinko, merke eta lantzeko erraza denez, zinka berunaren ordezko gisa erabiltzen da. Berunarekiko kezka hazten joan den heinean, zinka ordezko eraginkor gisa agertzen da hainbat aplikazioetarako: arrantzatik hasi[107], pneumatikoen oreka eta bolanteetaraino.[108]
Kadmio zink telurikoa nahastura erdieroale bat da, eta sentsore gailu txikien multzo batean banatu daitekeena.[109] Gailu horiek zirkuitu integratu baten antzekoak dira eta gamma izpien fotoien energia detektatu dezakete.[109] Maskara xurgatzaile baten atzean, nahastura honen sentsore multzoek izpien norabidea zehaztu dezakete.[109]
Beste erabilera industrialak

2009an, Amerikako Estatu Batuetako zinkaren ekoizpenaren laurden bat gutxi gorabehera zink konposatuetan kontsumitu zen[90]; hainbat industrialki erabiltzen direlarik. Zink oxidoa margoetan pigmentu txuri gisa eta gomaren fabrikazioan katalizatzaile gisa erabiltzen da, beroa ateratzeko. Zink oxidoa gomazko polimeroak eta plastikoak erradiazio ultramoretik babesteko erabiltzen da.[15] Zink oxidoaren propietate erdieroaleak direla eta, baristore eta fotokopiagailuetan erabilgarria da.[110] Zink zink-oxido zikloa bi urratsetako prozesu termokimikoa da, hidrogenoa sortzeko erabiltzen dena.[111]
Zink kloruroa sarritan zurean gehitzen da suaren aurkako babes gisa[10] eta batzuetan egur kontserbatzaile gisa[112]. Beste produktu kimikoen fabrikazioan erabiltzen da.[10] Zink metiloa (Zn(CH3)2) sintesi organiko askotan erabiltzen da.[113] Zink sulfuroa (ZnS) pigmentu lumineszenteetan erabiltzen da, hala nola, erlojuen orratzetan, X izpi eta telebistako pantailetan eta pintura lumineszenteetan.[9] ZnS kristalak laserretan erabiltzen dira, espektroaren erdialdeko infragorrietan lan egiten dutenetan zehazki.[114] Zink sulfatoa kimiko bat da pigmentu eta tindagaietan.[10] Zink piriotina zikinkeriaren aurkako pinturetan erabiltzen da.[115]
Zinka hautsa batzuetan propultsatzaile gisa erabiltzen da kohete modeloetan.[116] % 70 zink eta % 30 sufre hautsa duen konprimatutako nahasketa pizten denean erreakzio kimiko bortitz bat ematen da.[116] Honek zink sulfuroa sortzen du, gas beroa, beroa eta argi kantitate handiekin batera.[116]
Zink metal xaflak zink barrak egiteko erabiltzen da.[117]
64Zn, zinkaren isotopo ugarienak, aktibazio neutronikoa jasateko erraztasun handia dauka, oso erradioaktiboa den 65Zn bihurtuz. Honek 244 eguneko erdi-bizitza du eta gamma erradiazio handia sortzen du. Hori dela eta, erreaktore nuklearretan korrosioaren aurka erabiltzen den zink oxidoa 64Zn isotopoz xahutzen da erabili baino lehen. Arrazoi beragatik, zinka arma nuklearrak gatzatzeko material gisa proposatu da (kobaltoa beste gatzatze material bat da, ezagunagoa)[118]. 64Zn isotopoz hornitutako bonba nuklear batek, eztanda egiterakoan, 65Zn kantitate handiak sortuko lituzke, armaren erradioaktibitatea nabarmen handituz[118]. Ez dago informaziorik honelako arma bat inoiz eraiki, probatu edo erabili denik.[118]
65Zn trazatzaile gisa erabiltzen da, zinka daramaten metal-nahasturen higadura aztertzeko, edo zinkak organismoetan jarraitzen duen bidea eta rola aztertzeko.[119]
Zink ditiokarbonamato konplexuak nekazaritzako erabiltzen dira fungizidak gisa. Horien artean Zineb, Metiram, Propineb eta Ziram daude.[120] Zink naftalatoa zura kontserbatzekok erabiltzen da.[121] ZDDP formako zinka motor olioan erabiltzen da, higaduraren aurkako gehigarri gisa.[122]
Kimika organikoa

Organozink kimika karbono-zink loturak dituzten konposatuen zientzia da, hauen propietate fisikoak, sintesiak eta erreakzio kimikoak deskribatzen dituena. Organozink konposatu asko garrantzitsuak dira.[123][124][125][126] Aplikazio garrantzitsuen artean daude Frankland Duppa erreakzioa[127], Reformatsky erreakzioa[128], Simmons-Smith erreakzioa[129] eta Barbier erreakzioa[130].
Zinkak katalizatzaile moduan aplikazio asko ditu sintesi organikoetan, sintesi asimetrikoak barne. Metal preziatu konplexuen alternatiba merke eta eskuragarria da. Zinka katalizatzaile gisa erabiltzerakoan lortutako emaitzak (errendimendua eta ee) paladioarekin, rutenioarekin, iridioarekin eta besteekin lortzen direnaren antzekoak dira, eta zinka metalezko katalizatzaile aukera bat da.[131]
Osagarri dietetikoa

Pilula bakar batean eta erraz eskuratu daitezkeen eguneroko bitamina eta mineral osagarrietan, zinka zink oxido, zink azetato edo zink glukonato gisa egon ohi da.[132] Zinka antioxidatzaile gisa hartzen da normalean. Hala eta guztiz ere, erredox inertea da eta, beraz, funtzio horri era ez zuzenean soilik bete dezake.[133] Oro har, zink osagarria elementu honen gabezi arrisku handia dagoenean gomendatzen da (errenta ertain eta baxuko herrialdeak adibidez), prebentziozko neurri gisa.[134]
Zink gabezia depresio-nahasmendu larriarekin lotu da, eta zink osagarriak hartzea tratamendu eraginkorra izan daiteke.[135]
Zinka beherakoa tratatzeko erabiltzen da, batez ere garapen bidean dauden herrialdeetako umeen artean; tresna sinple, merke eta kritikoa baita. Beherakoa izatean zinka gorputzean agortu egiten da. Baina azken ikerketek iradokitzen dute zinka berreskuratzeko 10 eta 14 eguneko tratamendu bat jarraituz gero, beherakoaren iraupena eta larritasuna murrizten dela, eta etorkizuneko gertakariak saihestu ditzakeela hiru hilabetez.[136]
Cochraneko berrikuspen baten arabera, zink osagarria hartzen dutenek adinarekin erlazionatutako makularen degenerazioa garatzeko aukera gutxiago dituztela.[137]
Zink osagarria tratamendu eraginkorra da akrodermatitis enteropatikarako, zink xurgapenari eragiten dion nahasketa genetikorako. Aldez aurretik hilkorra zen kaltetuak ziren haurrentzat.[138]
Gastroenteritisa asko gutxitzen da zinka hartuz gero. Hau bi arrazoirengatik gertatu liteke: digestio aparatuko ioien mikrobioen aurkako eragin zuzenagatik edo zelula immuneen zinkaren xurgapena eta berriro askatzearen (granulozito guztiek askatzen dute zinka) ondorioz. Baliteke biak batera ere geratzea.[139][140]
2011n, ikertzaileek aurkitu zuten zink kantitate handiak gehitzen bazitzaizkion gernu-lagin bati, droga detekzioa ezeztatzen zuela. Ikertzaileek ez zuten ikertu zink osagarri dietetiko bat oralki kontsumitzeak efektu bera izan zezakeen edo ez.[141]
Zinka GABAA hartzailearen modulatzaile alosteriko negatiboa da.[142]
Hotzeria
Zink osagarriak (askotan zink azetato edo zink glukonato gozokiak) hotzeriaren tratamenduan erabiltzen diren osagarri dietetikoak dira.[143] Zink osagarriek, 75 mg eguneko baino dosi handiagoak hartuz gero (sintomak hasi eta 24 ordu baino lehenago hasita), hotzeriaren sintomak egun batez murrizten dituztela frogatu da.[143][144] Datuen gabezia dela eta, ez da nahikoa ebidentziarik zink osagarrien prebentziozko erabilerak hotzeria hartzeko aukera murrizten duela zehazteko.[144] Zink osagarrien efektu kaltegarriak ahoan, besteak beste, zapore txarra eta goragalea dira.[143][144] Zinka duten sudurrarentzako espraien erabilera usaimenaren galerarekin erlazionatua dagoela ikusi da.[143] Hori dela eta, 2009ko ekainean, Estatu Batuetako Droga eta Elikagaien Administrazioak kontsumitzaileei mota honetako produktuak erabiltzen uzteko abisua eman zuen.[143]
Gizakien errinobirusa, patogeno biralik arruntena gizakietan, hotzeriaren eragile nagusia da.[145] Zinkak hotzeriaren gogortasuna edo/eta iraupena murrizteko martxan jartzen duen mekanismoa ez dago argi. Zenbait ikerketen arabera, hantura nasala gutxitu edo desagertzea eta errinobirusaren hartzailearen loturaren inhibizio zuzena dira.[143]
Erabilera topikoa
Zinkaren erabilera topikoak larruazalean erabiltzen direnak izaten dira, askotan zink oxido moduan. Zink-prestakinek eguzkiak eragindako erreduren aurkako babesa ematen dute.[15] Haurraren pixoihala doan zonaldean (perineoan) pixka bat jarriz gero pixoihala aldatzen den bakoitzean, pixoihalak eragindako dermatitisaren aurkako babesa eskaini dezake.[15]
Zink mota batzuk hortzetako pasta eta aho garbitzaileetan erabiltzen dira, halitosia saihesteko.[146] Zink piritionea berriz, xanpuetan erabiltzen da, zahia saihesteko.[147]
Funtzio biologikoa
Zinka gizakientzat[148][149][150], beste animalia batzuentzat[151], landareentzat[84] eta mikroorganismoentzat[152] funtsezko aztarna elementua da. Zinka 300 entzimaren eta 1000 transkripzio faktore baino gehiagoren funtzionamendurako beharrezkoa da[150] eta metalotioneinetan gorde eta transferitu egiten da.[72][153] Mota honetako bigarren metal elementu ugariena da gizakietan burdinaren ondoren, eta entzima klase guztietan agertzen den metal bakarra da.[84][150]
Proteinetan, zink ioiak azido aspartikoaren, azido glutamikoaren, zisteinaren eta histidinaren aminoazidoen albo kateetan koordinatzen dira sarritan. Proteinetako zink lotura honen azalpen teoriko eta konputazionala (beste trantsizio metalekin ere gertatzen den bezala) zaila da.[154]
Gutxi gorabehera, 2-4 gramo zink[155] daude giza gorputzean zehar banatuta. Zink gehiena burmuinetan, giharretan, hezurretan, giltzurrunean eta gibelean dago, eta kontzentrazio handienak prostatan eta begiaren zatietan daude.[156] Semena bereziki aberatsa da zinkean, prostatako guruin funtzioaren funtsezko faktorea eta ugalketa organoen hazkundean.[157]
Gizakietan, zinkaren rol biologikoak nonahi daude.[6][149] "Ligando organiko sorta zabaletan" elkarreraginean datza[6], eta RNA eta DNAren metabolismoan, seinale transdukzioan eta gene-adierazpenean funtzioak ditu. Apoptosia ere arautzen du. 2006ko ikerketa batek giza proteinen % 10 inguru (2800) potentzialki zink loturak dituztela estimatu zuen. Honez gain, beste ehunka proteinek zinkaren garraio eta trafikoan parte hartzen dute.[84]
Burmuinetan, zinka besikula sinaptiko espezifikoetan gordetzen da neurona glutamatergikoen bidez eta neuronen kitzikakortasuna modulatu dezakete.[149][150][158] Plastikotasun sinaptikoan funtsezko papera betetzen du eta, beraz, ikaskuntzan.[149][159] Zink homeostasiak nerbio-sistema zentralaren erregulazio funtzionalean ere paper kritikoa jokatzen du.[149][150][158] L- eta D-histidinak burmuinetako zink hartzea errazten dute.[160] SLC30A3 burmuinetako zink homeostasian eragina duen zink garraiatzaile nagusia da.[149]
Entzimak

Zinka Lewis azido eraginkorra da, hidroxilazioan eta beste erreakzio entzimatikoetan agente katalitiko baliagarria delarik.[161] Metal honek koordinazio geometriko malgua du baita ere, eta horri esker, erabiltzen duten proteinek erreakzio biologikoak egiteko konformazioak bizkor aldatu ditzakete.[162] Zink duten entzimen bi adibide anhidrasa karbonikoa eta karboxipeptidasa dira, karbono dioxidoaren (CO2) proteinen erregulazio eta digestiorako funtsezkoak direnak, hurrenez hurren.[17]
Ornodunen odolean, anhidrasa karbonikoak CO2a bikarbonatoan bihurtzen du, eta entzima berak bikarbonatoa CO2an bihurtzen du biriken bidez botatzeko.[163] Entzima hau gabe, bihurketa hau milioi bat aldiz motelagoa litzateke[17] odolean arrunta den 7ko pHan edo 10 edo gehiagoko pHa beharko luke abiadura mantentzeko.[72] Erlaziorik ez duen anhidrasa β-karbonikoa landaretan beharrezkoa da hostoen formazioan, azido azetikoaren sintesian eta hartzidura alkoholikoan.[164]
Karboxipeptidasak peptidoen loturak mozten ditu proteinen digestioan zehar. Lotura kobalente koordinatu bat sortzen da terminal peptidoaren eta zinkari loturiko C=O talde baten artean, eta karbonoari karga positiboa ematen dio. Horrek zinkaren inguruko entziman poltsiko hidrofobiko bat sortzen laguntzen du, digestioan dagoen proteinaren alde ez-polarra erakartzen duena.[17]
Seinaleztapena
Zinkak mezulari funtzioa betetzen duela ikusi da, seinaleztapen bideak aktibatzeko gai delarik. Bide horietako askok minbizi hazkunde arraroak bultzatzen dituzte. ZIP garraiolarien bidez eraso daitezke.[165]
Beste proteina batzuk

Zink hatzetan zinkak funtzio soilik estrukturala betetzen du.[72] Zink hatzek transkripzio faktore batzuen zatiak osatzen dituzte. Faktore hauek ADNaren oinarrizko sekuentziak antzematen dituzten proteinak dira, ADNaren transkripzio eta erreplikazioan zehar. Zink hatzetan bederatzi edo hamar Zn2+ ioi egon ohi dira. Hauen funtzioa hatzaren estruktura mantentzea da. Horretarako, transkripzio faktoreko lau aminoazidoak lotzen dituzte.[17] Transkripzio faktorea ADNaren helizearen inguruan biltzen da eta hatzak erabiltzen ditu ADN sekuentziara egoki lotzeko.
Odol-plasman, zinka albumina (60%, afinitate baxua) eta transferrinari (% 10) lotu eta hauen bidez garraiatzen da.[155] Transferrinak burdina ere garraiatzen duenez, gehiegizko burdina izateak zinkaren xurgapena murrizten du, eta alderantziz. Antzeko antagonismoa ere kobrearekin eman ohi da.[erreferentzia behar] Odol-plasmako zink kontzentrazioa nahiko egonkorra izaten da, zink kontsumoarekin erlazio handirik gabe.[161] Listu-guruineko, prostatako, sistema immunologikoko eta hesteetako zelulek zink seinaleztapena erabiltzen dute beste zelula batzuekin komunikatzeko.[166]
Zinka metalotioneina erreserbetan gorde daiteke mikroorganismoetan, edo animalien heste edo gibeletan.[72] Hesteetako zeluletako metalotioneina zink xurgapena %15-40 tartean doitzeko gai da.[167] Hala eta guztiz ere, zink gutxiegi edo gehiegi hartzea kaltegarria izan daiteke. Gehiegizko hartzeak kobrezko xurgapena bereziki kaltetzen du, metalotioneinak bi metalak xurgatzen dituelako.[168]
Giza dopamina garraiatzaileak afinitate handiko zink elkartze gune bat du zelulatik kanpo. Zinka bertara lotzen denean, dopamina berrartzea inhibitzen du eta anfetaminak induzitutako dopamina kanporatzeko fluxua anplifikatzen du.[169][170][171] Giza serotonina eta noradrenalina garraiatzaileek ez dituzte zinka lotzeko guneak.[171]
Gomendio dietetikoak
Estatu Batuetako Medikuntzako Institutu Nazionalak (IOM) zinkaren Estimatutako Bataz besteko Beharrak (ingelesez, Estimated Average Requirements edo EARs) eta Gomendatutako Dieta bidezko Sarrerak (ingelesez, Recommended Dietary Allowances edo RDA) eguneratu zituen 2001. urtean. Zinkaren egungo EARak 14 urtetik gorako emakume eta gizonentzat 6,8 eta 9,4 mg/eguneko dira, hurrenez hurren. RDAk 8 eta 11 mg/eguneko dira. RDAk EAR baino altuagoak dira batezbesteko beharrak baino altuagoak dituzten pertsonen eskakizunak barne hartzeko. Haurdunaldiko RDA 11 mg/eguneko da. Edoskitzerako RDA 12 mg/eguneko da. 12 hilabeterainoko haurrentzat RDA 3 mg/eguneko da. 1 eta 13 urte bitarteko umeentzat berriz, kantitatea 3 mg/eguneko baloretik 8 mg-ra handitzen doa adinaren arabera.[172]
Elikagaien Segurtasuneko Europako Agintaritzak (EFSA) dietaren inguruko informazio multzoari Dietaren Erreferentzia Balioak deitzen dio. AEBtako RDAren ordez Biztanleriaren Erreferentzia Sarrera (ingelesez, Population Reference Intake edo PRI) erabiltzen du, eta Bataz besteko Beharra EAR beharrean. 18 urte edo gehiagoko jendearentzako PRIa kalkulatzeko dietaren fitato kopurua kontuan hartzen du. Horrela, fitato kopurua 300 mg-tik 1200 mg-ra igotzen den heinean, zink kantitatea 7,5 mg-tik 12,7 mg-ra igotzen da emakumeentzat eta 9,4 mg-tik 16,3 mg-ra gizonentzat. Kopuru hauek AEBtakoak baino altuagoak dira.[173] Eguneko dosi maximoa aldiz baxuagoa da, eta 25 mg/egunekoa da Europan, AEBtan 40 mg diren bitartean.[172][174]
Etiketatuei dagokienez, Estatu Batuetan eguneroko balioaren ehunekoetan azaldu behar da. Zinkaren etiketatzeari dagokionez, % 100 balioa 15 mg zen, baina 2016ko maiatzetik aurrera 11 mg-ra jaitsi da.[175] Enpresek 2020rako urtarrilaren 1a arteko tartea dute datu hau aldatu ahal izateko.[176]
Dieta bidezko sarrera

Animalien produktuek, esaterako, haragiak, arrainak, itsaskiak, hegaztiak, arrautzak eta esnekiek zinka dute. Landareen zink kontzentrazioa lurrean dagoen kontzentrazioaren araberakoa da. Lurrean zink egokia badago, zink gehien dituzten elikagaiak garia (germenak eta aleak) eta haziak dira, besteak beste, sesamo, mitxoleta, argi-belar, apio eta mostazarenak.[177] Zinka babarrunetan, fruitu lehorretan, arbendoletan, ale osoan, kuia pipitetan eta ekilore hazietan aurki daiteke baita ere.[178] Landareen fitatoak lekale eta zerealetan aurkitzen dira bereziki eta zinkaren xurgapena oztopatzen dute.
Beste iturri batzuk elikagai gotortuak eta hainbat motako osagarri dietetikoak dira. 1998ko berrikuspen batek ondorioztatu zuen zink oxidoa eta zink karbonatoa ia disolbaezinak direla eta gorputzak gaizki xurgatzen dituela.[179] Azterketa honek aipatzen zituen ikerketek ziotenaren arabera, plasman zink kontzentrazio baxuagoa zuten zink oxido eta zink karbonatoa kontsumitzen zuten pertsonek zink azetatoa eta sulfato gatzak hartzen zituztenekin alderatuta.[179] Elikagai gotortuen kasuan, hala ere, 2003. urteko berrikuspen batek zerealak (zink oxidoa dutenak) gomendatzen zituzten iturri finko eta merke gisa, garestiagoak ziren moduak bezain absortzio ona zutelarik.[180] 2005eko ikerketa baten arabera, zink konposatu desberdinak, oxidoa eta sulfatoa barne, ez zuten xurgapenean desberdintasun estatistikoki esanguratsurik adierazten arto opiletan eransten zirenean.[181]
Gabezia
Zink gabezia normalean dietaren bidez nahikoa ez hartzeagatik izaten da, baina absortzio txarrarekin, acrodermatitis enteropathicarekin, gibeleko gaixotasun kronikoekin, giltzurruneko gaixotasun kronikoekin, igitai zelularen gaixotasunarekin, diabetesarekin eta beste gaixotasun kroniko batzuekin lotu daiteke.[7] Zink gabezia jasateko arriskuan dauden taldeen artean, adinekoak, garapen bidean dauden herrialdeetako haurrak eta giltzurruneko disfuntzioa dutenak daude.
Zink gabezia leunaren sintomak anitzak dira.[161] Emaitza klinikoak honako hauek dira: hazkunde moteldua, beherakoa, inpotentzia eta sexu-heldutasunaren atzerapena, alopezia, begi eta larruazaleko lesioak, gosea murriztea, aldaketa kognitiboak, karbohidratoen erabileran akatsak eta ugalketa teratologia.[161] Zink gabezia leunak immunitatea murrizten du[182], baina gehiegizko zinkak baita ere.[155] Zink gabeziak duten animaliek bi aldiz elikagai gehiago behar dute pisua hartzeko zink nahikoa duten animaliekin alderatuta.[9]
Nahiz eta zenbait kezka egon[183], mendebaldeko barazkijale eta beganoek ez dute zink gabezia haragia jaten dutenak baino gehiago sufritzen.[184] Zinkaren landare-iturri nagusiak honako hauek dira: babarrunak, itsasoko barazkiak, zereal gotortuak, soja-elikagaiak, fruitu lehorrak, ilarrak eta haziak.[183] Hala ere, ale osoetan eta zuntzetan dauden fitatoek zinkaren xurgapena oztopatu dezakete, eta zink janaldi eskasaren ondorioak ez dira ondo ezagutzen. Zenbait ikerketen arabera, fitato altuko dieta bat jarraitzen dutenek eguneko zink kantitate gomendatua (15 mg) baino gehiago beharko lukete. Hau barazkijale batzuen kasua izan liteke.[183] Hala ere, gogoeta hauek egiterakoan kontuan izan behar da zinkaren biomarkatzaile egokiak eskasak direla, eta gehien erabiltzen denak, plasmako zinkak, sentsibilitate eta zehaztasun eskasa duela.[185] Honengatik, zink gabeziak diagnostikatzeak erronka izaten jarraitzen du.[6]
Garapen bidean dauden herrialdeetako bi mila milioi pertsona inguruk zink gabezia dute.[7] Umeetan, infekzioak eta beherakoa areagotzea eragiten du eta urtero 800.000 haurren heriotzan eragin zuzena du.[6] Munduko Osasun Erakundeak zink gehigarriak gomendatzen ditu desnutrizio larria eta beherakoa tratatzeko.[186] Zink osagarriek gaixotasunak prebenitzen eta hilkortasuna murrizten laguntzen dute, batez ere jaiotza-pisu baxua edo gelditutako hazkundea duten haurretan.[186] Hala eta guztiz ere, zink osagarriak ez lirateke bakarrik eman behar, askotan hainbat gabezi dituztelako, eta zinkak beste mikronutriente batzuekin elkar eragiten baitu.[187]
Lurzoruen konponketa
Ainar arrunt, Erica eta Vaccinium espezieak zink altuko lurzoruetan hazi daitezke, ioi toxikoen lekualdaketa micorriza ericoide onddoaren akzioak ekiditen baitu.[188]
Nekazaritza
Zink gabeziak nekazaritza-landareen mikronutriente gabezia ohikoena izaten dela dirudi. Bereziki ohikoa da pH handiko lurretan.[189] Zink gabezia jasaten dute landatzen diren Turkia eta Indiako lurren erdiak, Txinakoen herenak, eta Mendebaldeko Australiako gehienek. Zink ongarritzeak erantzun egokia eman duela ikusi da lurralde horietan.[84] Zink gabezia duten lurzoruetan hazten diren landareek gaixotasun gehiago jasaten dituzte. Era naturalean, zinka batez ere arroken erosioaren bitartez gehitzen da lurrera, baina gizakiak beste hainbat moduetan gehitu du: erregai fosilen errekuntza, meatzaritzako hondakinak, fosfato ongarriak, pestizidak... Gehiegizko zinka landareentzako toxikoa da, nahiz eta zink toxikotasuna oso gutxi hedatua dagoen.[84]
Arriskuak
Toxikotasuna

Zinka osasun ona izateko funtsezko baldintza den arren, gehiegizko zinka kaltegarria izan daiteke. Zinkaren gehiegizko xurgapenak kobrea eta burdinaren xurgapena eragozten du.[168] Soluzioan dagoen zink ioi askea oso toxikoa da landare, ornogabe eta baita arrain ornodunentzat ere.[190] Ioi Askearen Jarduera Eredua literaturan ongi frogatua dago, eta ioi librearen kantitate mikromolarrak organismo batzuk hiltzen direla erakusten du. 2006o ikerketa batek 6 mikromolek uretan zeuden Daphnia guztien % 93 hil zituela frogatu zuen.[191]
Zink ioi librea Lewis azido indartsua da, korrosiboa izateraino. Urdaileko azidoak azido klorhidrikoa du. Bertan zink metalikoa azkar disolbatzen da, korrosiboa den zink kloruroa sortuz. 1982tik aurrerako AEBtako zentimo bat (% 97,5ean zinkez osatua) irensteak urdaileko estaldurari kaltea eragin diezaioke, urdaileko azidoan zink ioiak duen disolbagarritasun altuarengatik.[192]
Ikerketek frogatzen dutenez, egunero 100-300 mg zink hartzen duten pertsonek kobre gabezia pairatu dezakete. 2007ko froga batean ikusi zenez, egunean 80 mg zink hartzen zuten adinduak gehiagotan izaten ziren gernu konplikazioengatik ospitalizatuak plazeboa hartzen zutenak baino.[193] Egunean 100-300 mg hartzeak kobrearen eta burdinaren erabilerari eragin diezaiokete, eta kolesterolean kalteberak eragin ditzakete.[168] Lurzoruan 500 ppm baino gehiagoko zinka badago, beste funtsezko metalen xurgapenean eragiten du, hala nola burdina eta manganesoa.[15] Zink astintzeak izeneko egoera bat sor daiteke, galbanizatutako materialak soldatzean sortzen diren zink keak arnastean.[9] Zinka hortz-protesietarako kremen duen osagai komun bat da, eta gramo bakoitzeko 17 eta 38 mg zink izan dezakete. Produktu horien gehiegizko erabilerak desgaitasuna eta baita heriotza ere sortu izana erreklamatu da.[194]
Estatu Batuetako Elikagai eta Sendagaien Administrazioak (ingelesez, Food and Drug Administration edo FDA) zinkak sudurreko nerbio-hartzaileetan kalteak sortzen dituela dio, anosmia eraginez. 1930. hamarkadan polio infekzioak sendatzeko zinka zuten sendagaiak erabili ziren, eta detektatu ziren anosmia kasuekin erlazioa izan dezakete. Sendagai hauek ez ziren baliagarriak izan.[195] 2009ko ekainaren 16an, FDAk zinkean oinarritutako hotzeria tratatzeko sudurrerako produktuak kentzea agindu zuen. FDAk esan zuen usain galerak bizitza arriskuan jartzen duela, usaimen gutxi duten pertsonek ezin dituztelako gas edo ke ihesak nabaritu, eta ezin dutelako esan elikagaiak hondatuak daudenik jan aurretik.[196]
Intoxikazioak
1982an, AEBetan kobrez estalitako baina gehienbat zinkarekin egindako zentimo txanponak erabiltzen hasi ziren. Zink zentimoek zink intoxikazioak sortzeko arriskua dute, heriotza eragin dezaketelarik. 425 zentimoren janaldi kroniko kasu baten ondorioz (zink kilo bat baino gehiago) heriotza bat gertatu zen heste eta urdaileko bakterioen eta onddoen septizemiaren ondorioz. 12 gramo zink jan zituen beste gaixo batek letargia eta ataxia (muskulu mugimenduen koordinazio falta handia) bakarrik jasan zituen.[197] Zinkdun txanponak irensteak sortutako pozoiduren beste hainbat kasu ere ezagutu dira.[198][199]
Zentimoak eta beste txanpon txiki batzuk txakurrek ere jaten dituzte batzuetan, eta albaitariek kendu behar dizkiete. Txanpon bidezko zink pozoitze hauek askotan hilgarriak dira txakurrentzat, anemia hemolitiko larria eta gibeleko edo giltzurrunetako kalteak eragiten baitituzte. Oka eta beherakoa sintoma posibleak dira.[200] Zinka oso toxikoa da loroentzat eta intoxikazioak sarritan hilgarriak izan daitezke.[201] Galbanizatutako latetan gordetako fruta-zukuen kontsumoak zink intoxikazioak eragin ditu loroetan.[15]
Erreferentziak
- «Of brass and bronze in prehistoric Southwest Asia» web.archive.org 2015-09-24 (Noiz kontsultatua: 2018-12-08).
- (Ingelesez) «The composition of the copper alloys used by the Greek, Etruscan and Roman civilizations: 3. The Origins and Early Use of Brass» Journal of Archaeological Science 5 (1): 1–16. 1978-03-01 doi:. ISSN 0305-4403. (Noiz kontsultatua: 2018-12-08).
- «Zinc - Element information, properties and uses | Periodic Table» www.rsc.org (Noiz kontsultatua: 2018-12-08).
- «India Was the First to Smelt Zinc by Distillation Process» www.infinityfoundation.com (Noiz kontsultatua: 2018-12-08).
- (Ingelesez) Gurjar, L.; Kharakwal, J.. (2006-12-01). «Zinc and Brass in Archaeological Perspective» Ancient Asia 1 (0) doi:. ISSN 2042-5937. (Noiz kontsultatua: 2018-12-08).
- Hambidge, K. Michael; Krebs, Nancy F.. (2007-4). «Zinc deficiency: a special challenge» The Journal of Nutrition 137 (4): 1101–1105. doi:. ISSN 0022-3166. PMID 17374687. (Noiz kontsultatua: 2018-12-08).
- (Ingelesez) Prasad, Ananda S.. (2003-02-22). «Zinc deficiency: Has been known of for 40 years but ignored by global health organisations» BMJ 326 (7386): 409–410. doi:. ISSN 1468-5833. PMID 12595353. PMC PMC1125304. (Noiz kontsultatua: 2018-12-08).
- Maret, Wolfgang. (2013). «Zinc and the zinc proteome» Metal Ions in Life Sciences 12: 479–501. doi:. ISSN 1559-0836. PMID 23595681. (Noiz kontsultatua: 2018-12-08).
- (Ingelesez) Lide, David R.. (2004-06-29). CRC Handbook of Chemistry and Physics, 85th Edition. CRC Press ISBN 9780849304859. (Noiz kontsultatua: 2018-12-08).
- (Ingelesez) Heiserman, David. (1991-10-01). Exploring Chemical Elements and Their Compounds. McGraw-Hill Companies,Incorporated ISBN 9780830630158. (Noiz kontsultatua: 2018-12-08).
- Wells, Alexander Frank. (2012-07-12). Structural Inorganic Chemistry. Oxford University Press ISBN 9780199657636. (Noiz kontsultatua: 2018-12-08).
- (Ingelesez) Scoffern, John. (1861). The Useful Metals and Their Alloys, Including Mining Ventilation, Mining Jurisprudence, and Metallurgic Chemistry Employed in the Conversion of Iron, Copper, Tin, Zinc, Antimony and Lead Ores; with Their Applications to the Industrial Arts. Houlston and Wright (Noiz kontsultatua: 2018-12-08).
- (Ingelesez) Association, American Galvanizer's. (2018-12-07). «Zinc Metal Properties» American Galvanizer's Association (Noiz kontsultatua: 2018-12-08).
- (Ingelesez) Ingalls, Walter Renton. (1902). Production and Properties of Zinc: A Treatise on the Occurrence and Distribution of Zinc Ore, the Commercial and Technical Conditions Affecting the Production of the Spelter, Its Chemical and Physical Properties and Uses in the Arts, Together with a Historical and Statistical Review of the Industry. Engineering and mining journal (Noiz kontsultatua: 2018-12-08).
- (Ingelesez) Emsley, John. (2003). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press ISBN 9780198503408. (Noiz kontsultatua: 2018-12-08).
- (Ingelesez) Hampel, Clifford A.. (1968). The Encyclopedia of the Chemical Elements. Reinhold Book Corporation ISBN 9780278916432. (Noiz kontsultatua: 2018-12-08).
- (Ingelesez) Greenwood, N. N.; Earnshaw, A.. (2012-12-02). Chemistry of the Elements. Elsevier ISBN 9780080501093. (Noiz kontsultatua: 2018-12-08).
- «Mineral Commodity Summaries 2015: Zinc» web.archive.org 2015-05-25 (Noiz kontsultatua: 2018-12-08).
- (Ingelesez) United States Geological Survey Professional Paper. U.S. Government Printing Office 1973 (Noiz kontsultatua: 2018-12-08).
- «Country Partnership Strategy—Iran: 2011–12» web.archive.org 2011-10-26 (Noiz kontsultatua: 2018-12-08).
- «IMAG - iranconmin.de - MARKET» web.archive.org 2013-02-17 (Noiz kontsultatua: 2018-12-08).
- «Mineral Commodity Summaries 2009: Zinc» web.archive.org 2016-07-02 (Noiz kontsultatua: 2018-12-08).
- Gordon, R. B.; Bertram, M.; Graedel, T. E.. (2006-01-01). «From the Cover: Metal stocks and sustainability» Proceedings of the National Academy of Science 103: 1209–1214. doi:. ISSN 0027-8424. (Noiz kontsultatua: 2018-12-08).
- Gerst, Michael D.; Graedel, T. E.. (2008-10-01). «In-Use Stocks of Metals: Status and Implications» Environmental Science and Technology 42: 7038–7045. doi:. (Noiz kontsultatua: 2018-12-08).
- (Ingelesez) «The anthropogenic cycle of zinc: Status quo and perspectives» Resources, Conservation and Recycling 123: 1–10. 2017-08-01 doi:. ISSN 0921-3449. (Noiz kontsultatua: 2018-12-08).
- «Interactive Chart of Nuclides» www.nndc.bnl.gov (Noiz kontsultatua: 2018-12-09).
- Hinshaw, G.; Weiland, J. L.; Hill, R. S.; Odegard, N.; Larson, D.; Bennett, C. L.; Dunkley, J.; Gold, B. et al.. (2009-02-01). «Five-Year Wilkinson Microwave Anisotropy Probe Observations: Data Processing, Sky Maps, and Basic Results» The Astrophysical Journal Supplement Series 180: 225–245. doi:. ISSN 0067-0049. (Noiz kontsultatua: 2018-12-09).
- Audi, G.; Bersillon, O.; Blachot, J.; Wapstra, A. H.. (2003-12-01). «The NUBASE evaluation of nuclear and decay properties» Nuclear Physics A 729: 3–128. doi:. ISSN 0375-9474. (Noiz kontsultatua: 2018-12-09).
- (Ingelesez) Porter, Frank C.. (1994-06-29). Corrosion Resistance of Zinc and Zinc Alloys. CRC Press ISBN 9780824792138. (Noiz kontsultatua: 2018-12-09).
- 1859-, Holleman, A. F. (Arnold Frederick),. (1985). Lehrbuch der anorganischen Chemie. (91.-100., verb. und stark erw. Aufl. / von Nils Wiberg. argitaraldia) De Gruyter ISBN 3110075113. PMC 14949442. (Noiz kontsultatua: 2018-12-09).
- (Ingelesez) Hinds, John Iredelle Dillard. (1905). Inorganic Chemistry: With the Elements of Physical and Theoretical Chemistry. Wiley (Noiz kontsultatua: 2018-12-09).
- Rob., Ritchie,. (2004). Chemistry. (New ed. argitaraldia) Letts Educational ISBN 1843154382. PMC 56447119. (Noiz kontsultatua: 2018-12-09).
- 1936-, Burgess, John,. (1978). Metal ions in solution. Ellis Horwood ISBN 0470262931. PMC 4442507. (Noiz kontsultatua: 2018-12-09).
- 1938-, Brady, James E.,. (1982). General chemistry : principles and structure. (3rd ed., SI version. argitaraldia) Wiley ISBN 047186739X. PMC 12452321. (Noiz kontsultatua: 2018-12-09).
- Kaupp, Martin; Dolg, Michael; Stoll, Hermann; von Schnering, Hans Georg. (1994-05-01). «Oxidation State +IV in Group 12 Chemistry. Ab Initio Study of Zinc(IV), Cadmium(IV), and Mercury(IV) Fluorides» Inorganic Chemistry 33 (10): 2122–2131. doi:. ISSN 0020-1669. (Noiz kontsultatua: 2018-12-09).
- 1955-, Housecroft, Catherine E.,. (2008). Inorganic chemistry. (3rd ed. argitaraldia) Pearson Prentice Hall ISBN 9780131755536. PMC 228102552. (Noiz kontsultatua: 2018-12-11).
- «Zinc Sulfide: AMERICAN ELEMENTS Supplier & Tech Info» archive.is 2012-07-17 (Noiz kontsultatua: 2018-12-11).
- Academic American encyclopedia.. Grolier Incorporated 1994 ISBN 0717220532. PMC 28150660. (Noiz kontsultatua: 2018-12-11).
- «Zinc Phosphide: AMERICAN ELEMENTS Supplier & Tech Info» archive.is 2012-07-17 (Noiz kontsultatua: 2018-12-11).
- Shulzhenko, A. A.; Ignatyeva, I. Yu.; Osipov, A. S.; Smirnova, T. I.. (2000-03-01). «Peculiarities of interaction in the Zn-C system under high pressures and temperatures» Diamond and Related Materials 9: 129–133. doi:. ISSN 0925-9635. (Noiz kontsultatua: 2018-12-11).
- «Wayback Machine» web.archive.org 2007-09-30 (Noiz kontsultatua: 2018-12-11).
- Handbook of inorganic compounds. CRC Press 1995 ISBN 0849386713. PMC 32347397. (Noiz kontsultatua: 2018-12-11).
- 1892-, Weeks, Mary Elvira,. ([2003]). The discovery of the elements. Kessinger Pub ISBN 0766138720. PMC 71322678. (Noiz kontsultatua: 2018-12-12).
- «World's oldest pills treated sore eyes - health - 07 January 2013 - New Scientist» web.archive.org 2013-01-22 (Noiz kontsultatua: 2018-12-12).
- Giachi, Gianna; Pallecchi, Pasquino; Romualdi, Antonella; Ribechini, Erika; Lucejko, Jeannette Jacqueline; Perla Colombini, Maria; Mariotti Lippi, Marta. (2013-01-01). «Ingredients of a 2,000-y-old medicine revealed by chemical, mineralogical, and botanical investigations» Proceedings of the National Academy of Science 110: 1193–1196. doi:. ISSN 0027-8424. (Noiz kontsultatua: 2018-12-12).
- «zinc: Definition and Much More From Answers.com» web.archive.org 2006-04-11 (Noiz kontsultatua: 2018-12-12).
- (Ingelesez) Chambers's Encyclopaedia: A Dictionary of Universal Knowledge. W. & R. Chambers, Limited 1901 (Noiz kontsultatua: 2018-12-12).
- 2000 years of zinc and brass. (Rev. ed. argitaraldia) British Museum 1998 ISBN 0861591240. PMC 40543567. (Noiz kontsultatua: 2018-12-12).
- (Ingelesez) Rehren, Thilo. «A Roman zinc tablet from Bern, Switzerland: reconstruction of the manufacture (Rehren 1996, ISA Ankara)» Archaeometry 1994 (ISA Ankara) (Noiz kontsultatua: 2018-12-12).
- (Ingelesez) Meulenbeld, Gerrit Jan. (1999). A history of Indian medical literature 1,A 1,A. Forsten ISBN 9789069801247. (Noiz kontsultatua: 2018-12-12).
- Crustal evolution and metallogeny in the northwestern Indian shield : a festschrift for Asoke Mookherjee. Alpha Science 2000 ISBN 1842650017. PMC 80463423. (Noiz kontsultatua: 2018-12-12).
- www.tandfonline.com doi:. (Noiz kontsultatua: 2018-12-12).
- (Ingelesez) «Zinc production in medieval India» ResearchGate (Noiz kontsultatua: 2018-12-12).
- (Ingelesez) Ray, Prafulla Chandra. (1903). A History of Hindu Chemistry from the Earliest Times to the Middle of the Sixteenth Century, A.D.: With Sanskrit Texts, Variants, Translation and Illustrations. Bengal Chemical & Pharmaceutical Works, Limited (Noiz kontsultatua: 2018-12-12).
- (Ingelesez) Discovering the 8th Metal-Zinc. (Noiz kontsultatua: 2018-12-12).
- (Ingelesez) Arny, Henry Vinecome. (1917). Principles of Pharmacy. W. B. Saunders (Noiz kontsultatua: 2018-12-12).
- Clark., Hoover, Herbert. (2003). Georgius agricola de re metallica.. Kessinger Pub. Co ISBN 0766131971. PMC 759686450. (Noiz kontsultatua: 2018-12-12).
- Gerhartz, executive ed.: Wolfgang. (1994). Ullmann's encyclopedia of industrial chemistry / Vol. A. Alphabetically arranged articles. 25, Starch and other polysaccharides to surfactants.. (5., completely rev. ed. argitaraldia) VCH Verl.-Ges ISBN 3527201254. PMC 311987978. (Noiz kontsultatua: 2018-12-12).
- (Ingelesez) Skeat, Walter W.; Skeat, Walter William. (2005). A Concise Etymological Dictionary of the English Language. Cosimo, Inc. ISBN 9781596050921. (Noiz kontsultatua: 2018-12-12).
- Handbook of extractive metallurgy. Wiley-VCH 1997 ISBN 3527287922. PMC 37891012. (Noiz kontsultatua: 2018-12-12).
- (Ingelesez) Lach, Donald F.. (2010-01-15). Asia in the Making of Europe, Volume II: A Century of Wonder. Book 3: The Scholarly Disciplines. University of Chicago Press ISBN 9780226467139. (Noiz kontsultatua: 2018-12-12).
- «Transition metal ellements» web.archive.org 2014-10-10 (Noiz kontsultatua: 2018-12-13).
- (Ingelesez) Vaughan, L. Brent. (2012-10-24). The Junior Encyclopedia Britannica; A Reference Library of General Knowledge Volume 3. Rarebooksclub.com ISBN 9781231735114. (Noiz kontsultatua: 2018-12-13).
- (Ingelesez) Habib, Irfan. (2011). Economic History of Medieval India, 1200-1500. Pearson Education India ISBN 9788131727911. (Noiz kontsultatua: 2018-12-13).
- www.tandfonline.com doi:. (Noiz kontsultatua: 2018-12-13).
- www.tandfonline.com doi:. (Noiz kontsultatua: 2018-12-13).
- (Ingelesez) The Elements. PediaPress (Noiz kontsultatua: 2018-12-13).
- (Ingelesez) Comyns, Alan E.. (2007-06-07). Encyclopedic Dictionary of Named Processes in Chemical Technology. CRC Press ISBN 9781420008647. (Noiz kontsultatua: 2018-12-13).
- 1974-, Gray, Leon,. (2006). Zinc. Marshall Cavendish Benchmark ISBN 0761419225. PMC 57692895. (Noiz kontsultatua: 2018-12-14).
- (Ingelesez) Warren, Neville G.. (2004). Physics. Pascal Press ISBN 9781740200851. (Noiz kontsultatua: 2018-12-14).
- (Ingelesez) Gilman, Daniel Coit; Peck, Harry Thurston; Colby, Frank Moore. (1903). The New international encyclopædia. Dodd, Mead and Co. (Noiz kontsultatua: 2018-12-14).
- Advanced inorganic chemistry.. (6th edition. argitaraldia) ISBN 0471199575. PMC 39147745. (Noiz kontsultatua: 2018-12-14).
- «Mineral Commodity Summaries 2007: Zinc» web.archive.org 2008-12-17 (Noiz kontsultatua: 2018-12-14).
- «Zinifex, Umicore Combine to Form Top Zinc Maker - WSJ» web.archive.org 2017-01-26 (Noiz kontsultatua: 2018-12-14).
- «Welcome to Zinc World - your Web Resource for all things Zinc» web.archive.org 2011-10-21 (Noiz kontsultatua: 2018-12-14).
- «Special High Grade Zinc (SHG) 99.995%» web.archive.org (Nyrstar) 2009-03-04 (Noiz kontsultatua: 2018-12-14).
- 1927-, Porter, Frank,. (1991). Zinc handbook : properties, processing, and use in design. M. Dekker ISBN 0824783409. PMC 23144901. (Noiz kontsultatua: 2018-12-14).
- Terkel., Rosenqvist,. (2004). Principles of extractive metallurgy. (2nd ed. argitaraldia) Tapir Academic Press ISBN 8251919223. PMC 58800505. (Noiz kontsultatua: 2018-12-14).
- Borg, G.. (2003-06-01). «Geology of the Skorpion Supergene Zinc Deposit, Southern Namibia» Economic Geology 98 (4): 749–771. doi:. ISSN 0361-0128. (Noiz kontsultatua: 2018-12-14).
- Colin., Bodsworth,. (1994). The extraction and refining of metals. CRC Press ISBN 0849344336. PMC 30079249. (Noiz kontsultatua: 2018-12-14).
- K., Gupta, C.. (1990). Hydrometallurgy in extraction processes. CRC Press ISBN 0849368049. PMC 21197603. (Noiz kontsultatua: 2018-12-14).
- (Ingelesez) Worrell, Ernst; Reuter, Markus. (2014-04-28). Handbook of Recycling: State-of-the-art for Practitioners, Analysts, and Scientists. Newnes ISBN 9780123965066. (Noiz kontsultatua: 2018-12-14).
- Kucha, H.; Martens, A.; Ottenburgs, R.; de Vos, W.; Viaene, W.. (1996-02-01). «Primary minerals of Zn-Pb mining and metallurgical dumps and their environmental behavior at Plombières, Belgium» Environmental Geology 27: 1–15. doi:. (Noiz kontsultatua: 2018-12-15).
- (Ingelesez) Broadley, Martin R.; White, Philip J.; Hammond, John P.; Zelko, Ivan; Lux, Alexander. (2007). «Zinc in plants» New Phytologist 173 (4): 677–702. doi:. ISSN 1469-8137. (Noiz kontsultatua: 2018-12-15).
- (Ingelesez) Heath, Alan G.. (1995-09-14). Water Pollution and Fish Physiology. CRC Press ISBN 9780873716321. (Noiz kontsultatua: 2018-12-15).
- «Derwent Estuary – Water Quality Improvement Plan for Heavy Metals» web.archive.org 2012-03-21 (Noiz kontsultatua: 2018-12-15).
- «Zinifex Zinc Smelter - Hobart, Tasmania» web.archive.org 2009-04-27 (Noiz kontsultatua: 2018-12-15).
- «Derwent Estuary – Water Quality Improvement Plan for Heavy Metals» web.archive.org 2012-03-21 (Noiz kontsultatua: 2018-12-15).
- «Zinifex Zinc Smelter - Hobart, Tasmania» web.archive.org 2009-04-27 (Noiz kontsultatua: 2018-12-15).
- «Zinc: World Mine Production (zinc content of concentrate) by Country"» web.archive.org 2011-06-08 (Noiz kontsultatua: 2018-12-15).
- Albert., Stwertka,. (1996). A guide to the elements. Oxford University Press ISBN 0195080831. PMC 33013451. (Noiz kontsultatua: 2018-12-15).
- (Ingelesez) Dalard, F.; Ghali, E.; Benzine, K.; Salhi, E.; Bounoughaz, M.. (2003-03-01). «A comparative study of the electrochemical behaviour of Algerian zinc and a zinc from a commercial sacrificial anode» Journal of Materials Science 38 (6): 1139–1145. doi:. ISSN 1573-4803. (Noiz kontsultatua: 2018-12-15).
- Handbook of battery materials. Wiley-VCH 1999 ISBN 9783527611669. PMC 310004401. (Noiz kontsultatua: 2018-12-15).
- Wiaux, J.-P.; Waefler, J.-P.. (1995). «Recycling zinc batteries: an economical challenge in consumer waste management» Journal of Power Sources 57: 61–65. doi:. ISSN 0378-7753. (Noiz kontsultatua: 2018-12-15).
- Culter, T.. (1996-6). «A design guide for rechargeable zinc-air battery technology» Southcon/96 Conference Record: 616–621. doi:. (Noiz kontsultatua: 2018-12-15).
- «Zinc Air Battery-Battery Hybrid for Powering Electric Scooters and Electric Buses» web.archive.org 2006-03-12 (Noiz kontsultatua: 2018-12-15).
- (Ingelesez) Cooper, J. F.; Fleming, D.; Hargrove, D.; Koopman, R.; Peterman, K.. (Thu Apr 20 00:00:00 EDT 1995). A refuelable zinc/air battery for fleet electric vehicle propulsion. (Noiz kontsultatua: 2018-12-15).
- (Ingelesez) «The developments and challenges of cerium half-cell in zinc–cerium redox flow battery for energy storage» Electrochimica Acta 90: 695–704. 2013-02-15 doi:. ISSN 0013-4686. (Noiz kontsultatua: 2018-12-15).
- The organ : an encyclopedia. Routledge 2006 ISBN 0415941741. PMC 58451784. (Noiz kontsultatua: 2018-12-15).
- «The United States Mint About Us» web.archive.org 2015-02-18 (Noiz kontsultatua: 2018-12-15).
- «Mineral Yearbook 1994: Zink» web.archive.org 2008-10-29 (Noiz kontsultatua: 2018-12-15).
- «Eastern Alloys, Inc. - Die casting Alloy (ZAMAK 2, ZAMAK 3, ZAMAK 5, ZAMAK 7, ZA-8, ZA-12, & ZA-27), Zinc Ingots» web.archive.org 2008-12-25 (Noiz kontsultatua: 2018-12-15).
- Apelian, D.; Paliwal, M.; Herrschaft, D. C.. (1981-11-01). «Casting with Zinc Alloys» JOM - Journal of the Minerals, Metals and Materials Society 33: 12–20. doi:. ISSN 1047-4838. (Noiz kontsultatua: 2018-12-15).
- Geoff., Davies,. (2003). Materials for automobile bodies. Elsevier, Butterworth Heinemann ISBN 9780750656924. PMC 162590522. (Noiz kontsultatua: 2018-12-15).
- Samans Carl H.. (1949). Engineering Metals And Their Alloys. (Noiz kontsultatua: 2018-12-15).
- 1927-, Porter, Frank,. (1994). Corrosion resistance of zinc and zinc alloys. M. Dekker ISBN 0824792130. PMC 30155481. (Noiz kontsultatua: 2018-12-15).
- (Ingelesez) Gardner, Keith. (1987). The Complete Book of Fishing: A Guide to Freshwater, Saltwater & Big-game Fishing. Gallery Books (Noiz kontsultatua: 2018-12-15).
- «Minoura Japan – Voluntary Recall Notice» web.archive.org 2013-03-23 (Noiz kontsultatua: 2018-12-15).
- I., Katz, Jonathan. (2002). The biggest bangs : the mystery of gamma-ray bursts, the most violent explosions in the universe. Oxford University Press ISBN 0195145704. PMC 70725246. (Noiz kontsultatua: 2018-12-15).
- Gregory., Zhang, Xiaoge. (1996). Corrosion and electrochemistry of zinc. Plenum Press ISBN 0306453347. PMC 35184009. (Noiz kontsultatua: 2018-12-15).
- «Development of Solar-powered Thermochemical Production of Hydrogen from Water» web.archive.org 2009-02-05 (Noiz kontsultatua: 2018-12-15).
- Laboratory (U.S.), Forest Products; Blew, Joseph Oscar. «Wood preservatives» ir.library.oregonstate.edu (Noiz kontsultatua: 2018-12-15).
- (Ingelesez) Frankland, E. von. (1849). «Notiz über eine neue Reihe organischer Körper, welche Metalle, Phosphor u. s. w. enthalten» Justus Liebigs Annalen der Chemie 71 (2): 213–216. doi:. ISSN 1099-0690. (Noiz kontsultatua: 2018-12-15).
- «Encyclopedia of Laser Physics and Technology - an Open Access Resource of In-Depth Information, Free Articles, Nonlinear and Fiber Optics» www.rp-photonics.com (Noiz kontsultatua: 2018-12-15).
- (Ingelesez) «Worldwide occurrence and effects of antifouling paint booster biocides in the aquatic environment: a review» Environment International 30 (2): 235–248. 2004-04-01 doi:. ISSN 0160-4120. (Noiz kontsultatua: 2018-12-15).
- «Demonstrations - Zinc + Sulfur» web.archive.org 2008-12-02 (Noiz kontsultatua: 2018-12-15).
- «Zinc Counters - technical information» web.archive.org 2008-11-21 (Noiz kontsultatua: 2018-12-15).
- «Weapons of Mass Destruction» ndupress.ndu.edu (Noiz kontsultatua: 2018-12-15).
- «Zinc | Encyclopedia.com» www.encyclopedia.com (Noiz kontsultatua: 2018-12-15).
- Ullmann's agrochemicals.. Wiley-VCH Verlag GmbH & Co. KGaA 2007 ISBN 9783527316045. PMC 72868955. (Noiz kontsultatua: 2018-12-15).
- F., Walker, J. C.. (2006). Primary wood processing : principles and practice. (2nd ed. argitaraldia) Springer ISBN 9781402043932. PMC 209934701. (Noiz kontsultatua: 2018-12-15).
- «ZDDP Engine Oil - Mustang Monthly» web.archive.org 2009-09-12 (Noiz kontsultatua: 2018-12-15).
- (Ingelesez) Overman, Larry E.; Carpenter, Nancy E.. (2005). «The Allylic Trihaloacetimidate Rearrangement» Organic Reactions (American Cancer Society): 1–107. doi:. ISBN 9780471264187. (Noiz kontsultatua: 2018-12-17).
- «The Chemistry of Organozinc Compounds: R-Zn - Google Books» web.archive.org 2016-04-14 (Noiz kontsultatua: 2018-12-17).
- (Ingelesez) Knochel, Paul; Jones, Philip. (1999). Organozinc Reagents: A Practical Approach. Oxford University Press ISBN 9780198501213. (Noiz kontsultatua: 2018-12-17).
- «Synthetic Methods of Organometallic and Inorganic Chemistry: Catalysis - Google Books» web.archive.org 2016-04-14 (Noiz kontsultatua: 2018-12-17).
- «Frankland-Duppa Reaction» www.drugfuture.com (Noiz kontsultatua: 2018-12-17).
- (Ingelesez) Reformatsky, Sergius. (1887). «Neue Synthese zweiatomiger einbasischer Säuren aus den Ketonen» Berichte der deutschen chemischen Gesellschaft 20 (1): 1210–1211. doi:. ISSN 1099-0682. (Noiz kontsultatua: 2018-12-17).
- Simmons, Howard E.; Smith, Ronald D.. (1958-10-01). «A NEW SYNTHESIS OF CYCLOPROPANES FROM OLEFINS» Journal of the American Chemical Society 80 (19): 5323–5324. doi:. ISSN 0002-7863. (Noiz kontsultatua: 2018-12-17).
- (Frantsesez) texte, Académie des sciences (France) Auteur du. (1899-01). «Comptes rendus hebdomadaires des séances de l'Académie des sciences / publiés... par MM. les secrétaires perpétuels» Gallica (Noiz kontsultatua: 2018-12-17).
- (Ingelesez) «Chiral zinc catalysts for asymmetric synthesis» Tetrahedron 71 (9): 1339–1394. 2015-03-04 doi:. ISSN 0040-4020. (Noiz kontsultatua: 2018-12-17).
- A., DiSilvestro, Robert. (2005). Handbook of minerals as nutritional supplements. CRC Press ISBN 0849316529. PMC 55518105. (Noiz kontsultatua: 2018-12-17).
- Maret, Wolfgang. (2013-01-01). «Zinc biochemistry: from a single zinc enzyme to a key element of life» Advances in Nutrition (Bethesda, Md.) 4 (1): 82–91. doi:. ISSN 2156-5376. PMID 23319127. PMC PMC3648744. (Noiz kontsultatua: 2018-12-17).
- Mayo-Wilson, Evan; Junior, Jean A; Imdad, Aamer; Dean, Sohni; Chan, Xin Hui S; Chan, Evelyn S; Jaswal, Aneil; Bhutta, Zulfiqar A. (2014-05-15). «Zinc supplementation for preventing mortality, morbidity, and growth failure in children aged 6 months to 12 years of age» Cochrane Database of Systematic Reviews doi:. ISSN 1465-1858. (Noiz kontsultatua: 2018-12-17).
- (Ingelesez) «Potential roles of zinc in the pathophysiology and treatment of major depressive disorder» Neuroscience & Biobehavioral Reviews 37 (5): 911–929. 2013-06-01 doi:. ISSN 0149-7634. (Noiz kontsultatua: 2018-12-17).
- Bhutta, Z. A.; Bird, S. M.; Black, R. E.; Brown, K. H.; Gardner, J. M.; Hidayat, A.; Khatun, F.; Martorell, R. et al.. (2000-12). «Therapeutic effects of oral zinc in acute and persistent diarrhea in children in developing countries: pooled analysis of randomized controlled trials» The American Journal of Clinical Nutrition 72 (6): 1516–1522. doi:. ISSN 0002-9165. PMID 11101480. (Noiz kontsultatua: 2018-12-17).
- Evans, Jennifer R; Lawrenson, John G. (2017-07-30). «Antioxidant vitamin and mineral supplements for slowing the progression of age-related macular degeneration» Cochrane Database of Systematic Reviews doi:. ISSN 1465-1858. (Noiz kontsultatua: 2018-12-17).
- (Ingelesez) Emsley, John. (2003). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press ISBN 9780198503408. (Noiz kontsultatua: 2018-12-08).
- Aydemir, Tolunay Beker; Blanchard, Raymond K.; Cousins, Robert J.. (2006-02-01). «Zinc supplementation of young men alters metallothionein, zinc transporter, and cytokine gene expression in leukocyte populations» Proceedings of the National Academy of Science 103: 1699–1704. doi:. ISSN 0027-8424. (Noiz kontsultatua: 2018-12-17).
- Valko, M.; Morris, H.; Cronin, M. T. D.. (2005). «Metals, toxicity and oxidative stress» Current Medicinal Chemistry 12 (10): 1161–1208. ISSN 0929-8673. PMID 15892631. (Noiz kontsultatua: 2018-12-17).
- (Ingelesez) Lents, Nathan H.; Venkatratnam, Abhishek. (2011-07-01). «Zinc Reduces the Detection of Cocaine, Methamphetamine, and THC by ELISA Urine Testing» Journal of Analytical Toxicology 35 (6): 333–340. doi:. ISSN 0146-4760. (Noiz kontsultatua: 2018-12-17).
- (Ingelesez) Smart, Trevor G.; Harvey, Robert J.; Dunne, Emma L.; Hosie, Alastair M.. (2003-04). «Zinc-mediated inhibition of GABAA receptors: discrete binding sites underlie subtype specificity» Nature Neuroscience 6 (4): 362–369. doi:. ISSN 1546-1726. (Noiz kontsultatua: 2018-12-17).
- (Ingelesez) «Office of Dietary Supplements - Zinc» ods.od.nih.gov (Noiz kontsultatua: 2018-12-18).
- Singh, Meenu; Das, Rashmi R. (2013-06-18). Zinc for the common cold. John Wiley & Sons, Ltd doi:. (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) CDC. (2017-09-26). «Antibiotics Aren’t Always the Answer» Centers for Disease Control and Prevention (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) Roldán, S.; Winkel, E. G.; Herrera, D.; Sanz, M.; Winkelhoff, A. J. Van. (2003). «The effects of a new mouthrinse containing chlorhexidine, cetylpyridinium chloride and zinc lactate on the microflora of oral halitosis patients: a dual-centre, double-blind placebo-controlled study» Journal of Clinical Periodontology 30 (5): 427–434. doi:. ISSN 1600-051X. (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) Marks, R.; Pearse, A. D.; Walker, A. P.. (1985). «The effects of a shampoo containing zinc pyrithione on the control of dandruff» British Journal of Dermatology 112 (4): 415–422. doi:. ISSN 1365-2133. (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) Maret, Wolfgang. (2013). «Zinc and Human Disease» Interrelations between Essential Metal Ions and Human Diseases (Springer, Dordrecht): 389–414. doi:. ISBN 9789400774995. (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) Prakash, Atish; Bharti, Kanchan; Majeed, Abu Bakar A.. (2015). «Zinc: indications in brain disorders» Fundamental & Clinical Pharmacology 29 (2): 131–149. doi:. ISSN 1472-8206. (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) Urade, Yoshihiro; Cherasse, Yoan; Cherasse, Yoan; Urade, Yoshihiro. (2017/11). «Dietary Zinc Acts as a Sleep Modulator» International Journal of Molecular Sciences 18 (11): 2334. doi:. PMID 29113075. PMC PMC5713303. (Noiz kontsultatua: 2018-12-18).
- Prasad, Ananda. (2008). Molecular Medicine 14 (5-6): 1. doi:. ISSN 1076-1551. PMID 18385818. PMC PMC2277319. (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) Sugarman, Barrett. (1983-01-01). «Zinc and Infection» Reviews of Infectious Diseases 5 (1): 137–147. doi:. ISSN 0162-0886. (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) Haase, Hajo; Rink, Lothar; Plum, Laura M.; Plum, Laura M.; Rink, Lothar; Haase, Hajo. (2010/4). «The Essential Toxin: Impact of Zinc on Human Health» International Journal of Environmental Research and Public Health 7 (4): 1342–1365. doi:. PMID 20617034. PMC PMC2872358. (Noiz kontsultatua: 2018-12-18).
- Brandt, Erik G.; Hellgren, Mikko; Brinck, Tore; Bergman, Tomas; Edholm, Olle. (2009). «Molecular dynamics study of zinc binding to cysteines in a peptide mimic of the alcohol dehydrogenase structural zinc site» Physical Chemistry Chemical Physics (Incorporating Faraday Transactions) 11: 975. doi:. ISSN 1463-9076. (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) Rink, Lothar. (2000/11). «Zinc and the immune system» Proceedings of the Nutrition Society 59 (4): 541–552. doi:. ISSN 0029-6651. (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) Wapnir, Raul A.. (1990-09-25). Protein Nutrition and Mineral Absorption. CRC Press ISBN 9780849352270. (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) Berdanier, Carolyn D.; Dwyer, Johanna T.; Feldman, Elaine B.. (2007-08-24). Handbook of Nutrition and Food. CRC Press ISBN 9781420008890. (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) Bitanihirwe, Byron K. Y.; Cunningham, Miles G.. (2009). «Zinc: The brain's dark horse» Synapse 63 (11): 1029–1049. doi:. ISSN 1098-2396. (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) «Zinc and cortical plasticity» Brain Research Reviews 59 (2): 347–373. 2009-03-01 doi:. ISSN 0165-0173. (Noiz kontsultatua: 2018-12-18).
- Yokel, Robert A.. (2006-11). «Blood-brain barrier flux of aluminum, manganese, iron and other metals suspected to contribute to metal-induced neurodegeneration» Journal of Alzheimer's disease: JAD 10 (2-3): 223–253. ISSN 1387-2877. PMID 17119290. (Noiz kontsultatua: 2018-12-18).
- (Ingelesez) Medicine, Institute of. (2000-01-09). Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. ISBN 9780309072793. (Noiz kontsultatua: 2018-12-19).
- Biochemical and physiological aspects of human nutrition. W.B. Saunders 2000 ISBN 072164452X. PMC 38573609. (Noiz kontsultatua: 2018-12-19).
- (Ingelesez) Kohen, Amnon; Limbach, Hans-Heinrich. (2005-11-01). Isotope Effects In Chemistry and Biology. CRC Press ISBN 9781420028027. (Noiz kontsultatua: 2018-12-19).
- Gadallah, M. A. A.. (2000-04-01). «Effects of indole-3-acetic acid and zinc on the growth, osmotic potential and soluble carbon and nitrogen components of soybean plants growing under water deficit» Journal of Arid Environments 44: 451–467. doi:. (Noiz kontsultatua: 2018-12-19).
- Ziliotto, Silvia; Ogle, Olivia; Taylor, Kathryn M.. (2018). «17. Targeting Zinc(II) Signalling to Prevent Cancer» Metallo-Drugs: Development and Action of Anticancer Agents (De Gruyter) 18 doi:. ISBN 9783110470734. (Noiz kontsultatua: 2018-12-21).
- static.smallworldlabs.com doi:. PMID 17728842. PMC PMC1952663. (Noiz kontsultatua: 2018-12-21).
- ND., Blake, Steve,. (2008). Vitamins and minerals demystified. McGraw-Hill ISBN 9780071489010. PMC 180878700. (Noiz kontsultatua: 2018-12-21).
- (Ingelesez) Fosmire, G. J.. (1990-02-01). «Zinc toxicity» The American Journal of Clinical Nutrition 51 (2): 225–227. doi:. ISSN 0002-9165. (Noiz kontsultatua: 2018-12-21).
- www.tandfonline.com doi:. (Noiz kontsultatua: 2018-12-21).
- Sulzer, David. (2011-02). «How Addictive Drugs Disrupt Presynaptic Dopamine Neurotransmission» Neuron 69 (4): 628–649. doi:. ISSN 0896-6273. PMID 21338876. PMC PMC3065181. (Noiz kontsultatua: 2018-12-21).
- (Ingelesez) Sitte, Harald H.; Gether, Ulrik; Freissmuth, Michael; Singer, Ernst A.; Nørregaard, Lene; Scholze, Petra. (2002-06-14). «The Role of Zinc Ions in Reverse Transport Mediated by Monoamine Transporters» Journal of Biological Chemistry 277 (24): 21505–21513. doi:. ISSN 1083-351X. PMID 11940571. (Noiz kontsultatua: 2018-12-21).
- «12 Zinc | Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc | The National Academies Press» web.archive.org 2017-09-19 (Noiz kontsultatua: 2018-12-23).
- «Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergiesdata=2017-08-28» web.archive.org (Noiz kontsultatua: 2018-12-23).
- «Tolerable Upper Intake Levels For Vitamins And Minerals» web.archive.org 2016-03-16 (Noiz kontsultatua: 2018-12-23).
- «Changes to the Nutrition Facts Panel – Compliance Date» web.archive.org 2016-08-08 (Noiz kontsultatua: 2018-12-23).
- «Changes to the Nutrition Facts Label» web.archive.org 2017-03-12 (Noiz kontsultatua: 2018-12-23).
- Foods & nutrition encyclopedia. (2nd ed. argitaraldia) CRC Press 1994 ISBN 0849389801. PMC 28963802. (Noiz kontsultatua: 2018-12-24).
- «Zinc content of selected foods per common measure» web.archive.org 2009-03-05 (Noiz kontsultatua: 2018-12-24).
- Allen, L. H.. (08 1998). «Zinc and micronutrient supplements for children» The American Journal of Clinical Nutrition 68 (2 Suppl): 495S–498S. doi:. ISSN 0002-9165. PMID 9701167. (Noiz kontsultatua: 2018-12-24).
- (Ingelesez) Rosado, Jorge L.. (2003-09-01). «Zinc and Copper: Proposed Fortification Levels and Recommended Zinc Compounds» The Journal of Nutrition 133 (9): 2985S–2989S. doi:. ISSN 0022-3166. (Noiz kontsultatua: 2018-12-24).
- Hotz, Christine; DeHaene, Jessica; Woodhouse, Leslie R.; Villalpando, Salvador; Rivera, Juan A.; King, Janet C.. (2005-5). «Zinc absorption from zinc oxide, zinc sulfate, zinc oxide + EDTA, or sodium-zinc EDTA does not differ when added as fortificants to maize tortillas» The Journal of Nutrition 135 (5): 1102–1105. doi:. ISSN 0022-3166. PMID 15867288. (Noiz kontsultatua: 2018-12-24).
- Ibs, Klaus-Helge; Rink, Lothar. (05 2003). «Zinc-altered immune function» The Journal of Nutrition 133 (5 Suppl 1): 1452S–6S. doi:. ISSN 0022-3166. PMID 12730441. (Noiz kontsultatua: 2018-12-24).
- American Dietetic Association; Dietitians of Canada. (2003-6). «Position of the American Dietetic Association and Dietitians of Canada: Vegetarian diets» Journal of the American Dietetic Association 103 (6): 748–765. doi:. ISSN 0002-8223. PMID 12778049. (Noiz kontsultatua: 2018-12-24).
- Freeland-Graves, J. H.; Bodzy, P. W.; Eppright, M. A.. (1980-12). «Zinc status of vegetarians» Journal of the American Dietetic Association 77 (6): 655–661. ISSN 0002-8223. PMID 7440860. (Noiz kontsultatua: 2018-12-24).
- Hambidge, Michael. (03 2003). «Biomarkers of trace mineral intake and status» The Journal of Nutrition 133 (3): 948S–955S. doi:. ISSN 0022-3166. PMID 12612181. (Noiz kontsultatua: 2018-12-24).
- «WHO | The impact of zinc supplementation on childhood mortality and severe morbidity» web.archive.org 2009-03-02 (Noiz kontsultatua: 2018-12-24).
- (Ingelesez) Young, Mark; Darnton-Hill, Ian; Gross, Rainer; Shrimpton, Roger. (2005-02-10). «Zinc deficiency: what are the most appropriate interventions?» BMJ 330 (7487): 347–349. doi:. ISSN 1756-1833. PMID 15705693. PMC PMC548733. (Noiz kontsultatua: 2018-12-24).
- Gadd, Geoffrey Michael. (2010-3). «Metals, minerals and microbes: geomicrobiology and bioremediation» Microbiology (Reading, England) 156 (Pt 3): 609–643. doi:. ISSN 1465-2080. PMID 20019082. (Noiz kontsultatua: 2018-12-24).
- «IFA : International Fertilizer Industry Association - Zinc in Soils and Crop Nutrition / Fertilizer use / Our selection / LIBRARY / HomePage / IFA» web.archive.org 2013-02-19 (Noiz kontsultatua: 2018-12-24).
- «Zinc Hazard to Fish, Wildlife, and Invertebrates: A Synoptic Review» web.archive.org 2012-03-06 (Noiz kontsultatua: 2018-12-24).
- (Ingelesez) «Mechanisms of chronic waterborne Zn toxicity in Daphnia magna» Aquatic Toxicology 77 (4): 393–401. 2006-05-25 doi:. ISSN 0166-445X. (Noiz kontsultatua: 2018-12-24).
- Bothwell, Dawn N.; Mair, Eric A.; Cable, Benjamin B.. (2003-3). «Chronic ingestion of a zinc-based penny» Pediatrics 111 (3): 689–691. ISSN 1098-4275. PMID 12612262. (Noiz kontsultatua: 2018-12-24).
- Johnson, Aaron R.; Munoz, Alejandro; Gottlieb, Justin L.; Jarrard, David F.. (2007-02). «High Dose Zinc Increases Hospital Admissions Due to Genitourinary Complications» The Journal of Urology 177 (2): 639–643. doi:. ISSN 0022-5347. (Noiz kontsultatua: 2018-12-24).
- «Lawsuits blame denture adhesives for neurological damage - St. Petersburg Times» web.archive.org 2010-02-18 (Noiz kontsultatua: 2018-12-24).
- (Ingelesez) Oxford, John Sidney; Öberg, Bo. (1985). Conquest of Viral Diseases: A Topical Review of Drugs and Vaccines. Elsevier ISBN 9780444805669. (Noiz kontsultatua: 2018-12-24).
- «FDA says Zicam nasal products harm sense of smell - Los Angeles Times» web.archive.org 2012-06-21 (Noiz kontsultatua: 2018-12-24).
- www.tandfonline.com doi:. (Noiz kontsultatua: 2018-12-24).
- (Ingelesez) Bennett, Daniel R.; Baird, Curtis J.; Chan, Kwok-ming; Crookes, Peter F.; Bremner, Cedric G.; Gottlieb, Michael M.; Naritoku, Wesley Y.. (1997-06-01). «Zinc Toxicity Following Massive Coin Ingestion» The American Journal of Forensic Medicine and Pathology 18 (2): 148–153. doi:. ISSN 0195-7910. (Noiz kontsultatua: 2018-12-24).
- pubs.rsna.org doi:. (Noiz kontsultatua: 2018-12-24).
- Stowe, C. M.; Nelson, R.; Werdin, R.; Fangmann, G.; Fredrick, P.; Weaver, G.; Arendt, T. D.. (1978-08-01). «Zinc phosphide poisoning in dogs» Journal of the American Veterinary Medical Association 173 (3): 270. ISSN 0003-1488. PMID 689968. (Noiz kontsultatua: 2018-12-24).
- (Ingelesez) Reece, R. L.; Dickson, D. B.; Burrowes, P. J.. (1986). «Zinc toxicity (new wire disease) in aviary birds» Australian Veterinary Journal 63 (6): 199–199. doi:. ISSN 1751-0813. (Noiz kontsultatua: 2018-12-24).
Ikus, gainera
| Taldea → ↓ Periodoa |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| 1 | 1 H |
2 He | |||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | |||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | |||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | |
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | |
| 6 | 55 Cs |
56 Ba |
* | 71 Lu |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
| 7 | 87 Fr |
88 Ra |
** | 103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
| * Lantanoideak | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb | |||||
| ** Aktinidoak | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No | |||||