Zelula kanpoko matrize
Zelula kanpoko matrizea edo matrize extrazelularra, zelulek jariatutako makromolekulaz osatutako sare urtsua da. Zelulekin batera ehunak osatzen dituzte, baina matrizearen egitura, funtzioa eta proportzioa oso aldakorrak izan daitezke ehun ezberdinetan. Ehun konektiboan matrizea ugaria da (hezurretan edo kartilagoan adibidez); epitelioan eta nerbio-ehunean, aldiz, urria (larruazalean edo bizkarrezur-muinean adibidez)[1].
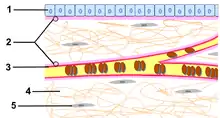
| Zelula kanpoko matrize | |
|---|---|
| Xehetasunak | |
| Identifikadoreak | |
| MeSH | A11.284.295.310 |
| TH | H2.00.03.0.02001 |
| Terminologia anatomikoa | |
Osagaiak
Zelula kanpoko matrizearen egitura osatzen duen ehunaren funtzioaren araberakoa da.
Glikosaminoglikanoak (GAG)
Disakaridoen errepikapenez eratutako kate polisakarido ez adarkatuak dira. Disakaridoak, amino-azukre batez (N-azetilglikosamina edo N-azetilgalaktosamina) eta azido uroniko batez osatuta daude. Polisakarido hauek negatiboki kargaturik daude sulfato eta karboxilo taldeei esker ( eta ). Karga negatibo hauen eraginez sodio ioiak erakartzen dituzte () eta sodio ioiek ur molekulak erakartzen dituzte osmosi bidez. Lau talde nagusitan banatzen dira: azido hialuronikoa, kondroitin sulfatoa eta dermatan sulfatoa, heparan sulfatoa eta keratan sulfatoa.[1]
Polipeptidoek ez bezala, GAG-ek konformazio zabalak hartzen dituzte, hidrofilikoak baitira; horrela, beraien masa molekularrarekiko bolumen handiak betetzen dituzte eta matrizea gel erakoa bihurtzen dute (nahiz eta polisakarido kontzentrazioa txikia izan). Ehun konektiboetan, GAG-ek, proteina fibrotsu estrukturalen masaren %10 baina pisu gutxiago dute. Hala ere, osatutako gel egiturak hartzen duen bolumenari esker erresistentzia handia ematen dio ehunari.[1]
Proteoglikanoak
Proteina zentral batzuei lotura kobalente bidez GAG-ak (azido hialuronikoa izan ezik) lotzerakoan eratzen diren glikoproteinak dira. Lotura hauek, proteinaren serina aminoazidoan (Ser) sortzen dira. Proteoglikano izateko, proteinak gutxienez GAG kate bat izan behar du loturik. Proteoglikanoek, gainera, gainontzeko glikoproteinek baina hidrokarburo masa handiagoa izan ohi dute. Proteoglikanoak oso heterogeneoak dira, kobalenteki lotzen zaizkion GAG-ak luzera, mota eta kopuru ezberdinetakoak baitira; beraz hauen funtzioak ere heterogeneoak dira.[1][2]
Proteglikano batzuk azido hialuronikoarekin elkartu eta kolageno sareen artean geratzen diren egitura handiak eratzen dituzte; adibidez, agrekano proteoglikanoak (kartilagoko proteoglikano nagusia). Beste batzuk kolagenoarekin eta glikoproteina atxikikorrekin lotzen dira, azken hauek gel egituraren barnean murgilduz; adibidez, perlekanoa (oinaldeko xaflako proteoglikano nagusia).[2]
Glikoproteina Atxikikorrak (GPA)
Zelula kanpoko matrizea antolaturik eta zelulak matrizera elkarturik mantentzen laguntzen duten proteinak dira. Horretarako, osagai ezberdinekin loturak sortzeko guneak dituzten domeinuak dituzte. GPA nagusiak: fibronektina, tenaszina, laminina, entaktina (edo nidogenoa).
- Fibronektina: Ehun konektiboan nagusi den GPA dimerikoa da, disulfuro zubiekin elkartutako 2.500 aminoazido inguruko bi kate polipeptidikoz osatua. Kolagenoarekin, proteoglikanoetako GAG-ekin eta zelulekin lotzeko guneak ditu. Zelulen migrazioan ere garrantzia duen proteina da.[1][2]
- Laminina: Oinaldeko xaflako GPA nagusia da, α, β eta γ azpiunitatez osatutako trimeroa. Kolagenoarekin, zelulako hartzaile batzuekin, integrinekin (matrize extrazelularra eta zelularen zitoeskeletoa elkartzen dituen proteina bat), nidogenoekin eta hainbat proteoglikanorekin loturak sortzeko guneak ditu. α kateak integrinekin, perlekanoekin eta distroglikanoarekin lotzeko guneak ditu muturrean eta integrinekin lotzeko gunea gunean. β kateak beste lamininekin lotzeko gunea du muturrean eta γ kateak beste lamininekin eta nidogeno edo entaktinarekin lotzkeo guneak ditu muturrean. Konfigurazioaren aldetik, hiru kateek 50nm inguruko domeinu helikoidal superkiribildu bat osatzen dute kateen muturretik hasita (domeinuaren hasieran α kateak hainbat lotura gune ditu) eta gero kate bakoitzak norabide ezberdin bat hartzen du beste 30nm inguru luzatuz (lotura guneak dituzte).[3][2]
Kolagenoa
Animalietan topatzen den proteina familia ugaria da (ugaztunen proteina masaren %25). Ehun konektiboko zelulek exozitatzen dute gehien bat eta hezurretan eta larruazalean osagai nagusia da. Prolinan (Pro), glizinan (Gly) eta hidroxiprolinan (Hyp) aberatsak diren 3 α-katez osatutako helizea da. Gly-X-Y sekuentzia etengabe errepikatzen da kate hauetan, X eta Y edozein aminoazido izanik (X posizioan prolina egon ohi da eta Y posizioan hidroxiprolina). Prolinak eta hidroxiprolinak, duten egiturari esker, helizea egonkortzen dute; glizinak, aminoazido txikiena izanik, helizea oso elkartuta egotea baimentzen du. Gainera, glizinak beste kateetako aminoazidoekin hidrogeno zubiak era ditzake helize hirukoitza egonkortuz.[4][5][2]

Kolagenoaren kate polipeptidikoak erretikulu endoplasmatiko pikortsuan sintetizatzerakoan ez da hidroxiprolinarik ezta hidroxilisinarik (Hyl) agertzen. Hauen ordez, prolina eta lisina (Lys) kodetzen dira eta aldaketa batzuen bidez prolina batzuk hidroxiprolinan eta lisina gehienak hidroxilisinan eraldatzen dira; honela, helize hirukoitzak hidrogeno zubi gehiago eratu ditzake. Aminoazido eraldatu hauek oso gutxitan topatzen dira bestelako proteinetan, hidroxiprolina landareen zelula paretako glikoproteina batzutan ugaria izan arren.[2]
25 α-kate ezberdin ezagutzen dira, bakoitza gene ezberdin batek kodetuta; honela, berez 15.000 kolageno motak existitu beharko lukete, baina 30 bat mota soilik identifikatu dira. Kolageno helizeek (300nm luze), zelula kanpoko matrizera exozitatzerakoan, kolageno mikrozuntzak eratzen dituzte helize ezberdinetako lisina eta hidroxilisina aminoazidoen artean sortzen diren lotura kobalenteei esker. Kolageno mikrozuntzak elkartuz, kolageno zuntzak eratzen dira eta hauek eremu argiko argi mikroskopioarekin ikusi daitezke.[1][5][2]
Hala ere, kolageno mota guztiek ez dituzte kolageno mikrozuntzak eratzen; batzuk, Gly-X-Y sekuentziaren etenaldiengatik, egitura helikoidala galdu eta mikrozuntzak osatu ordez, elkarrekin gurutzamenduak sortuz, bi dimentsiotako sareak sortzen dituzte (IV, VI eta XVIII motako kolagenoek adibidez).[2]
Elastina
Elastikotasuna behar duten ehunetako matrize extrazelularrean topatzen den proteina da (biriketan edo larruazalean adibidez). Proteina hidrofobiko honek, kolagenoa bezala, glizina eta prolina asko ditu. Elastina polipeptidoek sare bat osatzen dute lisina aminoazidoen arteko lotura kobalenteen bidez elkartuta mantenduz eta sare honek uzkurtu eta zabaltzeko gaitasun handia du.
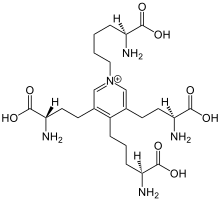
Lisinen arteko loturak sortzeko lisil oxidasa entzimak parte hartzen du. Lisina askoren amino taldea () aldehido taldearengatik () ordezkatzen du eta kate bateko 2 lisinen eta beste kate paralelo bateko 2 lisinen erradikalak (batek amino taldea eta beste hiruek aldehido taldea dutela) kondentsatzen dira desmosina eraztuna eratuz. Modu honetan, elastina kateak kobalenteki loturik geratzen dira.
Funtzioak
Esan bezala, zelula kanpoko matrizearen bolumena, osaera, egitura eta proportzioa aldakorra da ehun bakoitzean eta honek erlazio zuzena dauka funtzioarekin. Beraz funtzioek ez dute garrantzi berdina izango ehun bakoitzean. Funtzio nagusiak:
- Erresistentzia ematea: GAG-ek eratutako gel egiturari eta kolagenoari esker. Hezurretako matrize extrazelularrean kaltzio fosfato () kristalizatuari esker baita ere; gatz ezberdinak osatzen dituzte, adibidez hidroxiapatita, ().[6]
- Elastikotasuna ematea: Elastinari esker. Tentsioa sortzerakoan elastinak konformazioa aldatzen du eta tentsioa galtzerakoan, hasierako konformaziora itzultzen da. Larruazalean, bihotzean eta odol hodietan garrantzitsua.
- Zelulak atxikirik mantentzea: GPA eta zelulen zitoeskeletoaren arteko loturei esker. Hemidesmosomak piru ertainekin eta ukipen lokalak mikropiruekin (aktinazko piruak).
- Zelulen arteko komunikazioa ahalbidetzea: Seinale-molekulak hartzaile espezifikoak dituzten zeluletara garraiatzen ditu.
- Konposatuak selektiboki iragaztea: Matrizearen gel egiturari esker partikulak tamainaren eta kargaren arabera higitzen dira (geleko poroengatik eta GAG-en kargengatik).
- Zelulen garapena, migrazioa, desberdintzapena, forma eta portaera erregulatzen ditu.
- Organismoaren homeostasi normala mantentzen laguntzen du.[7]
Modu honetan zelulek eta zelula kanpoko matrizeak elkarrekiko erlazioa dute. Zelulek kanpo matrizea sortu, jariatu eta mantentzen dute eta matrizeak zelulen ezaugarrietan eta jardueran eragiten du.[8]
Oinaldeko Xafla
Epitelioen oinaldean eta muskulu zelulen, Schwann zelulen (nerbio ehunean) eta adipozitoen inguruan topatzen den 40nm-120nm arteko xafla proteikoa da. Lodiera ezberdinekoa izan daiteke, 20nm eta 5μm bitartean. Gehien bat IV motako kolagenoz eta lamininaz (GPA) osatuta dago, nahiz eta konposizioa aldakorra izan. Proteina nagusi hauek bi dimentsiotako sare bat eratzen dute eta gehien bat entaktinak (GPA) eta perlekanoak (heparan sulfatoa duen proteoglikano bat) ahalbidetzen dute proteina hauen arteko atxikidura. Gainera, xaflaren porositatea zehazten dute, makromolekula batzuekiko iragazgaitza eginez (barrera honek garrantzia du giltzurrunean, gernuaren osaketan).[6][9][2][3]
Iragazpen selektibo horretaz gain, oinaldeko xaflak babes fisikoa ematen du. Epitelioari eta ehun konektiboari lotuta dagoenez, epitelioak indar bat jasaten badu (azalean adibidez), oinaldeko xaflak zuzenean ehun konektiboari transmititzen dio. Ehun konektiboa oso erresistentea da zelula kanpoko matrizean ugaria delako (zelula kanpoko matrizearen funtzioetako bat ehunari erresistentzia ematea da, kolagenoari eta GAG-ek eratutako gel egiturari esker). Zelula eta oinaldeko xafla lotzen dituzten proteinen artean integrinak eta distroglikanoak dira nagusi; lamininarekin edo IV motako kolagenoarekin eta zelularen zitoeskeletoarekin loturak osatzen dituzte.[6]
Enbrioietan, zelula mota batek baina gehiagok parte hartzen dute oinaldeko xafla berdinaren sintesian. Adibidez, epitelioek laminina sintetizatzen dute eta mesenkimek entaktina.[6]
Landareen Zelula Pareta
Landare-zelulak matrize extrazelular ezberdin batez daude inguratuta, zelula pareta. Animalien zelula kanpoko matrizean proteinak dira osagai nagusia, baina landareen zelula paretan aldiz polisakaridoak.[9]
Landareen zelula pareta bi geruzatan dago banatua: pareta primarioa eta sekundarioa. Zelula ezberdinen pareta primarioen artean tarteko lamela egoten da askotan, pareta primarioak bananduz.[9]
Landare zelula pareten osagai nagusia zelulosa da, β-D-glukopiranosaren polimero ez-adarkatua (β(1→4) lotura). Zelulosa mintz plasmatikoan dauden entzima batzuk (transmintz proteinak) sintetizatzen dute zuzenean matrize extrazelularrera. Uste da entzima hauek zelularen kortikan dauden mikrotubuluei asoziatuta daudela eta mikrotubulu hauei esker mugitzen direla mintz plasmatikoan zehar. Zelula kanpoko matrizean 36 zelulosa polimero elkartu egiten dira paraleloki, 5nm inguruko mikrozuntzak eratuz. Mikrozuntz hauek ez dira berdin orientatzen zelula pareta primarioan eta sekundarioan (pareta primarioan orden zehatzik gabe kokatzen dira eta pareta sekundarioan ordenaturik agertzen dira). Mikrozuntz hauei lotuta bi polisakarido nagusi (adarkatuak) topatzen dira: hemizelulosa eta pektina.[6][2]
Hemizelulosa eta pektina Golgiren aparatuan sintetizatzen dira eta eta besikulen bidez jariatzen dira zelula kanpoko matrizera. Hemizelulosak zelulosazko mikrozuntzak estaltzen ditu, hidrogeno zubien bidez elkartuz. Pektinak, karga negatiboa ematen dion azido galaktouronikoan aberatsa denez, katioiak () erakartzen ditu, eta honekin batera, ura. Honi esker, pektinak mikrozuntzen artean gel egitura bat eratzen du (pektina, mermeladak egiteko erabiltzen da).[6]
Landare zelulak hazten ari direla, hauen zelula pareta zabaltzen doa. Zabalkuntza horretan laguntzen duen proteina bat identifikatu da, espansina, zelulosazko mikrozuntzak berrantolatzen parte hartzen baitu.[6]
| Zelula Pareta Primarioa | Zelula Pareta Sekundarioa |
|---|---|
| Hazten ari diren zeluletan dagoen pareta da. Zelularekin batera zabaltzeko gai da, nahiko mehea baita (1μm-5μm).
Zelulosa, hemizelulosa eta pektina kantitate antzekoa dauka. Landare zelula ezberdinen zelula pareta primarioak tarteko lamelaren bidez elkarturik daude; honek zelula pareten arteko atxikidura sendoa ahalbidetzen du, tarteko lamela hau pektinan ugaria baita.[10][9][2] |
Zelularen hazkuntza amaitzean sortzen den zelula pareta da. Pareta primarioa baina lodiagoa (10μm inguru gehienetan) eta zurrunagoa da, pektinan urria eta zelulosan ugaria, beraz ez da gai zabaltzeko. Ligninak (polimero fenoliko hidrofoboa, egurrean ugaria) pareta deshidratatzen du patogenoen ondoriozko degradazioa saihestuz, eta honi esker zuhaitzak luze bizi daitezke.[9][2] |
Funtzioak
- Presio osmotikoari aurre egitea. Animalietan ez bezala, landareetan zelula kanpoko matrizearen eta zitosolaren oreka osmotikoak ez dira berdinak, eta landare zelulek osmosi bidez ura jaso eta puztutzeko joera dute. Zelula paretari esker, presio osmotiko hau ekiditen da.[2]
- Barrera fisiko gisa jardutea. Bakterio, onddo eta birusetatik babesten ditu zelulak; beraz, hauek zelula infektatzeko, zelula pareta degradatuko duten entzimak jariatu behar dituzte.[9]
- Karbohidrato erreserba moduan erabiltzea. Landare askoren hazietako zelula paretak aberatsak dira xiloglukanoan (hemizelulosa mota bat) eta hazteko energia behar duenean, zelulak, polisakarido horiek hidrolizatu eta monosakaridoak lortzeko entzimak jariatzen ditu.[9]
Onddoen Zelula Pareta
Onddo zelulek, landareen moduan, zelula pareta bat dute (matrize extrazelular berezia). Onddoen kasuan, zelulosan ugaria izan ordez, kitina polisakaridoan da ugaria. Kitina N-azetilglukosaminaren polimero ez adarkatua da (β(1→4) lotura).
Erreferentziak
- (Ingelesez) Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter. (2002). «The Extracellular Matrix of Animals» Molecular Biology of the Cell. 4th edition (Noiz kontsultatua: 2018-11-22).
- M., Cooper, Geoffrey. ([2014]). La célula. (6a. ed. argitaraldia) Marbán ISBN 9788471019479. PMC 870272833. (Noiz kontsultatua: 2018-12-06).
- Biología molecular de la célula. (5a. ed. argitaraldia) Omega D.L. 2010 ISBN 9788428215077. PMC 688376223. (Noiz kontsultatua: 2018-12-10).
- (Ingelesez) Mecham, Robert. (2011-02-16). The Extracellular Matrix: an Overview. Springer Science & Business Media ISBN 9783642165559. (Noiz kontsultatua: 2018-12-03).
- Molecular cell biology. (4th ed. argitaraldia) W.H. Freeman 2000 ISBN 0716731363. PMC 41266312. (Noiz kontsultatua: 2018-11-27).
- (Ingelesez) «1416023887 - Cell Biology, Updated Edition: with Student Consult Online Access by Thomas D Pollard Md; William C Earnshaw Phd Frs; Jennifer Lippincott-schwartz Phd - AbeBooks» www.abebooks.com (Noiz kontsultatua: 2018-12-05).
- (Ingelesez) «Extracellular matrix structure» Advanced Drug Delivery Reviews 97: 4–27. 2016-02-01 doi:. ISSN 0169-409X. (Noiz kontsultatua: 2018-12-03).
- Yue, Beatrice. (2014). «Biology of the Extracellular Matrix: An Overview» Journal of glaucoma: S20–S23. doi:. ISSN 1057-0829. PMID 25275899. PMC PMC4185430. (Noiz kontsultatua: 2018-11-27).
- E., Sadava, David. (1993). Cell biology : organelle structure and function. Jones and Bartlett Publishers ISBN 0867202289. PMC 26350547. (Noiz kontsultatua: 2018-12-05).
- (Ingelesez) Walter, Peter; Roberts, Keith; Raff, Martin; Lewis, Julian; Johnson, Alexander; Alberts, Bruce. (2002). «The Plant Cell Wall» Molecular Biology of the Cell. 4th edition (Noiz kontsultatua: 2018-12-08).