Txikipedia:Molekula
Molekula bi atomok edo gehiagok osatzen duten egitura da. Molekularen barruko atomo horiek "lotura kimikoak" deitutako indar batzuen bidez daude elkarturik.
Elektrikoki neutroa da molekula.
Kimika deitzen den diziplina zientifikoak aztertzen ditu molekulen osaera gobernatzen duten arauak.
Molekulen hainbat errepresentazio erabiltzen dira molekulak eta haien forma (edo egitura) irudikatzeko; sinpleenak formula kimikoak dira: hauek sinbolo bana erabiltzen dute atomoak irudikatzeko.
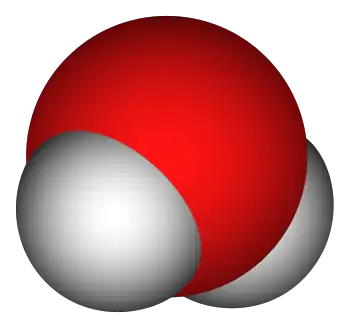
Adibidez, hidrogenoaren sinboloa H da, eta oxigenoarena O. Horrela, ur-molekula oxigeno atomo batez eta bi hidrogeno atomoz osatua dagoenez, haren formula H2O da.
Lotura kimikoak
Atomoen joera normala beste atomo batzuekin elkartzea da, molekulak osatuz. Hori zenbait elkarte edo lotura egonkor eratuz egiten dute. Dena den, gas nobleak alde batera uzti behar dira, elkartzeko joerarik ez dutelako.
Elkarte horiek hainbat eratakoak izan litezke eta lotura kimiko deritze. Lotura kimikoak atomoak, ioiak edo molekulak elkarturik iraunarazten dituzten indarrak dira eta haibat lotura-mota daude: ionikoa, kobalentea edo metalikoa.
Molekulak bi atomok bereizirik baino energia gutxiago duenez, egonkorragoa da; eta naturan egitura egonkorrek gehiago irauten dute.
Loturak hautsi ere egin daitezke. Lotura gehienak osatzeko energia beharrezkoa denez, lotura apurtzean ere energia askatzen dute. Baina lotura gehienek beroa behar dute apurtu baino lehen; hau da, molekula berotu egin behar da. Ondoren, atomoak mugitzen hasten dira, eta, gehiegizko mugimenduaren ondorioz, lotura hautsi egiten dute. Bestalde, badaude molekulak hausten direnean osatzen direnean baino energia gutxiago behar dutenak; horiei erregaiak deritze. Esate baterako, metanoa, butanoa, kandela... Piztutako pospolo bat kandela bati hurbiltzen zaionean, denbora luzez erreko da. Pospoloak lehenbiziko lotura hausteko energia du. Lehenbiziko lotura apurtzean, energia gehiago askatzen da, eta beheko loturak energia horren bidez apurtu daitezke kandela erre arte.
Lotura ionikoa
Hainbat eta hainbat molekula ez daude atomo neutroz eratuta, ioiz eratuta baizik eta hauei molekula ionikoak esaten zaie. Horien artean gatzak ditugu.
Elementu baten atomoek karga positiboa edo negatiboa har dezakete, ioiak sortuz. Zeinu desberdinetako ioien artean eragiten duten erakarpen-indar elektrostatikoen eraginez eratzen den loturari lotura ionikoa deritzo.
Lotura kobalentea
Molekula egon dadin, atomoek elkarrekin egon behar dute. Hori gertatzen da bi atomoek elektroiak partekatzen dituztelako. Atomo batean egon beharrean, elektroia bi atomoen inguruan mugituko da. Horri lotura kobalentea deritzo. Batzuetan, elektroi bat baino gehiago dago partekatuta. Elektroi gehiago partekatzen direnean, lotura indartsuagoa lortzen dugu. Horrela, lotura kobalente bikoitza eta hirukoitza sor dezakegu.
Lotura metalikoa
Metalak oso elementu ugariak dira. Merkurioa izan ezik, beste guztiak solidoak dira giro-tenperaturan eta sare kristalinoak eratzen dituzte.
Egitura metalikoa elkarrekin bildurik dauden atomoen multzo ordenatutzat har daiteke. Atomo horiek galdu egiten dituzte beren balentzia-elektroiak, halako molden no ioi positibo bihurtzen diren, eta aldi berean balentzia-elektroiek atomoen artean dauden hutsarteetatik libre higi daitezkeen hodei elektronikoa eratzen dute.
Hodei elektronikoaren eta ioi positiboen arteko elkarrekintzak bermatu egiten du metalaren egonkortasuna. Biltzeko modu horri lotura metalikoa deritzo. Lotura metalikoa ez da lotura kobalentea bezain bortitza, eta ahalbidetu egiten du atomoen geruza batzuk beste batzuen gainean irristatzea presio baten eraginpean.