Taula periodikoa
Taula periodikoa elementu kimikoen antolaketa mota bat da. Taularen forman nabarmen agertzen da antolamendua: bertan, elementu kimikoak beren atomo zenbakiaren,[1] konfigurazio elektronikoaren eta propietate kimikoen arabera daude ordenaturik zazpi errenkada eta hemezortzi zutabetan. Taula antolatzeko modu horrek antzekotasun periodikoak adierazten ditu; adibidez, antzeko portaera duten elementu kimikoak zutabe berean daude kokaturik. Theodor Benfeyren hitzetan, taula periodikoa «kimikaren bihotza da», eta haren garrantzia «konparagarria da eboluzioaren teoriarekin edo lege fisiko klasikoarekin».[2]

Taulan ageri diren errenkadak periodo hitzaz ezagutzen dira, eta zutabeak, talde hitzaz. Zenbait taldek izen bereziak dituzte;[3] adibidez: 17. taldeko elementuei halogeno deritze, eta, 18. taldekoei, gas noble.[3] Bestetik, lau bloke ezberdinetan banatzen da taula, eta propietate kimikoen[4] arabera antolatzen dira taldeak. Elementu guztiak ordena jakin batean kokatzen dira; horregatik, erraz ondoriozta daitezke elementuen propietateen arteko harremanak, eta taula periodikoa tresna baliogarria da elementuen portaera kimikoa aztertzeko. Kimikaren arloan erabiltzeaz gain, beste hainbat zientzietan ere erabiltzen da.

Taula periodikoaren lehen bertsioa 1869. urtean argitaratu zen Dmitri Mendeleieven eskutik. Berak elementuen joera periodikoak erakusteko prestatu zuen taula, eta, horretarako, elementuak propietate kimikoen[5] arabera sailkatu zituen. Bestetik, Julius Lothar Meyerrek ere antzeko beste taula bat garatu zuen 1870ean, baina sailkapena propietate fisikoen eta atomoen arabera eginez.[5] Mendeleievek ordu arte ezezagunak ziren elementu batzuen propietateak aurreikusi zituen, eta, aldi berean, elementu ezezagun horiek taularen leku hutsetan kokaturik egongo zirela iradoki zuen. Gerora, elementu berriak aurkitzean, Mendeleievek eginiko iragarpen gehienak zuzenak zirela egiaztatu zen.
Ordutik aurrera, taula garatuz eta zuzenduz joan da etengabe. Elementu berrien aurkikuntzak eta eredu teoriko berrien garapenak joera kimikoen azterketa ahalbidetu du, eta, horrekin batera, taula periodikoaren hobekuntzak osatu dira. Taula periodikoaren gaur egungo egitura Alfred Wernerrek egindakoa da Mendeleieven eredua eredutzat hartuz.[6]
Taularen adierazpen grafikoa
Gaur egun, eredu sinpleenean, itxura hau du taula periodikoak:
| Taldea → ↓ Periodoa |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| 1 | 1 H |
2 He | |||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | |||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | |||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | |
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | |
| 6 | 55 Cs |
56 Ba |
* | 71 Lu |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
| 7 | 87 Fr |
88 Ra |
** | 103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
| * Lantanoideak | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb | |||||
| ** Aktinidoak | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No | |||||
| Serie kimikoak (hondo kolorea): | ||||
| Metal alkalinoak | Metal lurralkalinoak | Lantanoideak | Aktinidoak | Trantsizio-metalak |
| Metalak | Metaloideak | Ez-metalak | Halogenoak | Gas nobleak |
Hainbat urteren buruan, 1 eta 118 bitarteko zenbaki atomikodun elementu kimiko guztiak aurkitu eta identifikatu dira; berrikitan, 113, 115, 117, 118 elementuak egiaztatu, izendatu eta sinbolizatu dira IUPAC (International Union of Pure and Applied Chemistry) nazioarteko erakundeak 2015eko abenduaren 30ean eginiko biltzar orokorrean.[7][8] Elementu horien izen eta ikur ofizialak 2016ko azaroaren 28an eman ziren argitara.
Lehenengo 94 elementuak naturan daude identifikaturik, nahiz eta horietariko asko kantitate txikietan aurkitu diren edo laborategietan sintetizatu ziren naturan aurkituak izan baino lehen. Bestalde, 95-118 bitarteko zenbaki atomikodun elementuak ez daude naturan, eta laborategietan sintetizatutakoak dira; horien artean, 95-100 bitartekoak naturan aurki zitezkeen aspaldiko garaietan, baina gaur egun ez dira naturan existitzen.[9]
Taula periodikoaren ortotipografia eta bestelako informazioak
Goian erakutsitako taula periodikoa bertsio sinplifikatua da, eta, gehienetan, beste hainbat informazio gehitzen dira taulako elementu bakoitzari dagokion gelaxkaren barruan. Horren adibide modura, euskaraz prestaturiko taularen beste bertsio osatuago bat jarriko dugu jarraian.
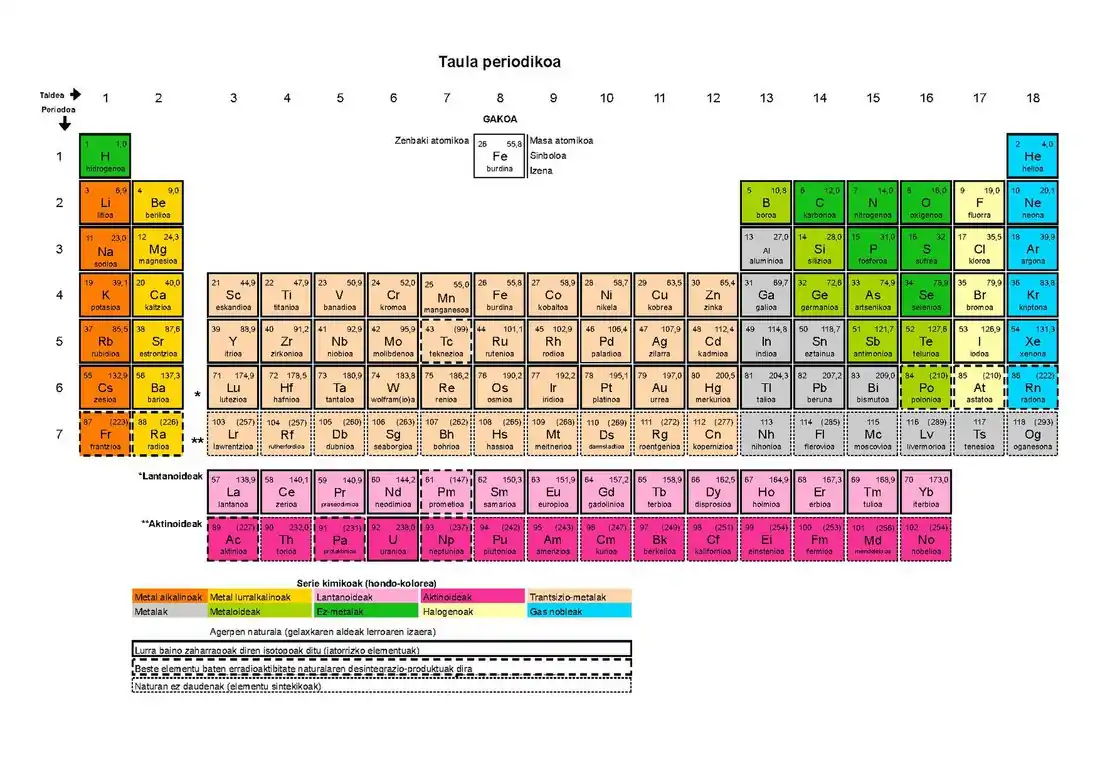
Kasu honetan, goiko gakoan adibide modura azalduta dauden posizio estandarretan, informazio hauek gehitu dira elementu bakoitzaren gelaxkan: zenbaki atomikoa (goialdeko ezkerraldean), masa atomikoa (goialdeko eskuinaldean), ikurra (gelaxkaren zentroan) eta euskarazko izena (behealdea zentraturik, artikulu eta guzti idatzita). Horrez gain, elementua zein serie kimikotakoa den ere azaltzen da gelaxkaren hondo-kolorearen bidez; koloreen gakoa taularen azpian dago (metal alkalinoak, metal lurralkalinoak, lantanoideak, aktinidoak, trantsizio-metalak, metalak, metaloideak, ez-metalak, halogenoak eta gas nobleak). Bestalde, gelaxka inguratzen duten lerroen izaera (lerro beteak, lerro etenak edo puntukako lerroak) zein den erakusten da azpialdean, elementua naturala den ala ez azalduz; alegia, elementuak Lurra baino zaharragoak diren isotopoak dituen (jatorrizko elementuak), beste elementu baten erradiaktibitate naturalaren desintegrazio-produktuak diren edo naturan ez daudenak diren (sintektikoak direlako).
Elementu kimikoen izena eta ikurra
Elementu kimikoen izena eta ikurra IUPAC erakundeak erabakitako arau ortotipografikoak betez idazten dira.
- Elementu gutxi batzuen izenak antzinatik, kimika sortu aurretik, erabiltzen ziren tokian tokiko hizkuntza arruntean. Euskaraz ere badira horrelakoak, esaterako, urre, zilar, berun, kobre, sufre, merkurio (kasu honetan artikulu barik emanez). Izen horiek bere horretan erabiltzen dira euskaraz. Eta modu berean jokatzen da beste hizkuntzetan ere, antzinako izena errespetatuz.
- Izen gehienak kimika garatu ahala jarritakoak dira, eta, idazkerari dagokionez, erdi-nazioartekoak dira; horrek esan nahi du sustrai berbera dutela hizkuntza guztietan, baina hizkuntza bakoitzaren araberako fonetika eta ortografiara egokiturik erabiltzen direla; euskaraz ere berdintsu. Horrelakoak dira aspalditik ezagunak diren elementu batzuen izenak, hala nola oxigeno, hidrogeno, kloro, iodo...
- Bestetik, azken bi mendeetan, elementu berriei zientzialari, lurralde edo antzekoen ohorez osatutako izena jartzeko ohitura sortu da eta izen horiek IUPACek antolaturiko biltzar nagusietan adostasunez onartzeko. Horiek ere erdi-nazioartekoak dira; izan ere, ohoretuaren izenaren sustraia errespetatuz moldaketa fonetiko ortografikoak egiten dira hizkuntza bakoitzean: lawrentzio, frantzio, radio, polonio...
Izenak, hizkuntza guztietara molda daitezkeen arren, elementu kimikoen ikurrak IUPACen arau dira; alegia, unibertsalak dira, hizkuntza guztietan berberak. Ezaugarri hauek betetzen dituzte:
- Beti idazten dira letrakera zuzen arruntez (ez letrakera etzanez) eta lehenengo letra larriz hasita: S, Ti, Uut...
- Ikur batzuek letra bakarra dute, hala nola O, H, N, F... Gehienek bi letra dituzte, eta, orduan, lehena larria da, eta, bigarrena, xehea: Os, Hg, Na, Fr...
- Azken urteotan detektatu eta identifikatu diren elementu kimikoei (zenbaki atomikoa 112 edo handiagoa dutenak) latinezko behin-behineko izen deskriptiboak eman zitzaizkien hasieran, eta hiru letraz osaturiko ikurra (Uub, Uut, Uuq...). Azken urteotan, IUPAC erakundeak arautu egin ditu elementu horien izenak eta ikurrak. Honelaxe geratu dira azkenean:
| Zenbaki atomikoa | Behin-behineko izena | Behin-behineko ikurra | Araututako izena | Araututako ikurra | Noiz arautua |
| 112 | ununbio | Uub | kopernizio | Cn | 2010 |
| 113 | ununtrio | Uut | nihonio | Nh | 2016 |
| 114 | ununkuadio | Uuq | flerovio | Fl | 2012 |
| 115 | ununpentio | Uup | moskovio | Mc | 2016 |
| 116 | ununhexio | Uuh | livermorio | Lv | 2012 |
| 117 | ununseptio | Uus | teneso | Ts | 2016 |
| 118 | ununoktio | Uuo | oganeson | Og | 2016 |
Taula periodikoaren historia
Taula periodikoaren historiak harreman estua dauka kimika eta fisikaren garapenarekin.
- Taula periodikoaren elementuen aurkikuntza.
- Propietate komunen azterketa eta elementuen sailkapena.
- Masa atomikoaren nozioa (hasieran, pisu atomiko deitua) eta, geroago, jada XX. mendean, masa-zenbakia.
- Masa atomikoaren (eta, geroago, zenbaki atomikoaren) eta elementuen propietate periodikoen eta elementu berrien agerpenaren arteko erlazioak.
Sistematizaziorako lehenengo saiakerak
Taula periodikoaren historiaren abiapuntu modura, 1789an, Antoine Lavoisier-ek hogeita hamahiru elementuz osatutako zerrenda bat argitaratu zuen. Elementu horiek lau multzotan sailkatu zituen; gasak, metalak, ez-metalak eta ez-gasak.[10][11] Baina sailkapen hori laster baztertu zen propietate fisiko eta kimikoen artean ezberdintasun nabarmenak zeudelako. Une horretatik aurrera, kimikariak sailkatze-lanetan aritu ziren. Horien artean, Johann Wolfgang Döbereiner izeneko kimikari alemaniarra aipa daiteke, sailkapen berri bat aurkeztu baitzuen 1829an, eta taulan agertzen ziren elementu asko hirukotetan bana zitezkeela ondorioztatu zuen, propietate kimikoen arabera. Esate baterako, litioa, sodioa eta potasioa «hirukote leuna» zeritzon talde batean sailkatu ziren. Gerora, beste talde batzuetan horrelako harremanak gertatzen zirela ondorioztatu zuen; hala nola kloro, iodo eta bromoaren artekoa. Hiru elementuez osatutako talde horiei hirukote edo triada[12] izena jarri zitzaien. Handik gutxira, 1843rako, Leopold Gmelinek hamar hirukote identifikatu zituen metodo hori erabiliz, eta baita hiru laukote eta boskote bat ere.
Geroago, Jean Baptiste Dumasek metal ezberdinen artean gertatzen ziren harremanez hitz egin zuen 1857an argitaratutako lan batean. Nolanahi ere, kimikari askok elementu ezberdinen arteko harremanak identifikatu zituzten arren, oraindik ez zegoen haiek sailkatzeko eskema argirik. Baina, 1857an bertan, August Kekulé kimikari alemana konturatu zen karbonoak lau atomo zituela itsatsirik askotan. Metanoak, adibidez, karbono-atomo bat eta lau hidrogeno-atomo ditu.[13] Fenomeno hori azaltzeko, balentzia[14] kontzeptua proposatu zuen; elementu ezberdinek atomo-kopuru ezberdinekin egiten dute bat. Horrela, 1864ean, Julius Lothar Meyer alemaniarrak, berrogeita lau elementuz osaturiko taula bat argitaratu zuen balentziaren arabera ordenaturik. Taula horrek erakutsi zuen antzeko propietateak zituzten elementuek balentzia berdina zutela kasu askotan.[15] Urte berean, William Odlingek berrogeita hamazazpi elementuz osatutako taula bat argitaratu zuen. Taula horretan, elementuak pisu atomikoaren arabera antolaturik ageri ziren. Gerora, balentzian oinarritutako sailkapen bat aurkeztu zuen 1870ean.
Elementuen aurkikuntza
Nahiz eta elementu batzuk, hala nola urrea (Au), zilarra (Ag), kobrea (Cu), beruna (Pb) eta merkurioa (Hg), aintzinarotik ezagutuak ziren, elementuen lehen aurkikuntza zientifikoa XVII. mendean gertatu zen, zehazki, Henning Brandek fosforoa[16] aurkitu zuenean. Ondoren, beste hainbat elementu berri aurkitu ziren XVIII. mendean; horien arteko garrantzitsuenak gasak izan ziren: oxigenoa (O), hidrogenoa (H) eta nitrogenoa (N), besteak beste. Garai hartan, elementuen kontzepzio berri bat garatu zen; hain zuzen ere, haren harira garatu zuen Antoine Lavoisier-ek bere zerrenda. Bestalde, XIX. mendearen hasieran, pila elektrikoa erabiltzen hasi ziren elementu kimikoen azterketan, eta metodo horrek elementu kimiko berrien aurkikuntza ekarri zuen, hala nola metal alkalinoena. Horrela, berrogeita hamabost elementu ezagutzen ziren jadanik 1830ean. Gerora, XIX. mendearen erdialdean, espektroskopiaren asmakuntzarekin, elementu berriak aurkitu ziren; batik bat, zesioa, talioa eta antzeko elementuak. Eta, XX. mendean, prozesu erradioaktiboen ikerketa-lanekin, beste hainbat elementu aurkitu ziren. Azkenean, taula periodikoan, 118 elementu biltzera igaro gara geure egunotan.
Elementuen nozioa eta propietate periodikoak
Elementu hitza greziera zaharretik dator, baina, kimikan, elementu hitzak duen esanahi modernoa XVII. mendetik aurrera ezarri zen; dena den, prozesu horren nondik norakoa zein den zehaztea ez da kontu erraza. Zenbait pentsalarik Robert Boyleren obra hartzen dute abiapuntutzat. Kimikari eszeptikoa zen bera, eta, bere lanean, Boyle elementu hitzaz aritu zen, esanez gorputz primitibo eta sinpleak zirela eta ez zeudela beste gorputzez osaturik. Izatez, azalpen hori Aristotelesen lau elementuen teoriari eginiko kritika bat zen.
Geroagom, taulen konposizio kimikoa ulertzeko modu berri bat osatu zuten kimikariek XVIII eta XIX. mendeetan zehar. Elementu kimikoak ulertzeko modu berri hori Lavoisierren eskutik jaso zuten hasiera batean, Kimikaren tratatu elementala izeneko lanean aritu baitzen hortaz. Lavoisierrek bereizketa bat proposatzen zuen: ezagunak ziren substantzien artean elementu kimikoak bereiztea, uste izanik horrela elementu kimiko horien propietateak hobeto ulertuko zirela. Bide horretatik abiaturik, elementu berri askoren aurkikuntzak eta elementu horien propietateen azterketak eginez, antzekotasun ugari agertzen zirela ondorioztatu zuen. Horrek kimikarien interesa piztu zuen eta sailkatze-modu berri baten garapena abiarazi zuen.
Masa atomikoak
XIX. mendearen hasieran, John Dalton-ek atomismoaren kontzepzio berri bat garatu zuen. Ikerketa meteorologikoak eta gas atmosferikoen azterketa zehatza izan ziren kontzepzio berri honen abiarazleak. Ekarpen nagusia atomismo kimikoa delakoaren eskutik etorri zen. Atomismo kimikoaren formulazio berriak Lavoisiarren definizioarekin egiten zuen bat. Daltonek hidrogeno-atomo baten masa hartu zuen erreferentzia-unitate gisa. Ordutik aurrera, masa atomiko (edo pisu atomiko) terminoa erabiltzen da elementu bakoitzaren isotopoen masa atomikoen batezbestekoa adierazteko, eta informazio hori taula periodikoaren barnean sartzen da.
Newlandsen zortzidun legea
John Newlands kimikari ingelesak, 1863tik 1866ra bitartean, dokumentu sorta bat egin zuen, eta adierazi zuen elementuak pisu atomikoaren goranzko ordenan zerrendatzen direnean, antzeko propietate fisiko eta kimikoak zortziko tarteetan errepikatzen direla[Oh 1]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Li 6,9 Na 23,0 K 39,0 | Be 9,0 Mg 24,3 Ca 40,0 | B 10,8 Al 27,0 | C 12,0 Si 28,1 | N 14,0 P 31,0 | O 16,0 S 32,1 | F 19,0 Cl 35,5 |
Aldizkakotasun hori musikaren zortzidunekin alderatu zuen[17][18]. Zortzidun lege deritzon horri, iseka egin zioten Newlandsen garaikideek, eta Chemical Society-k bere lana argitaratzeari uko egin zion[19], betetzeari uzten ziolako kaltzioaren ondoren. Newlandsek, ordea, elementuen taula bat egin, eta falta ziren elementuen existentzia iragartzeko erabili zuen, hala nola germanioa[20]. Chemical Society-k Mendeleiev-i kreditatu zitzaizkionetik bost urtera bakarrik aitortu zituen bere aurkikuntzak[21], eta, geroago, Royal Society-k aitortu zuen, zeinak bere saririk gorena eman zion Newlandsi, Davy Medaila[22].
1867an, Gustavus Hinrichs daniar kimikariak espiral sistema periodiko bat argitaratu zuen espektroetan, pisu atomikoetan eta beste antzekotasun kimiko batzuetan oinarrituta. Bere lana konplikatuegitzat jo zuten, eta, beraz, ez zuten onartu[23][24].
Mendeleieven taula
Dmitri Mendeleiev kimikariak 1869an argituratu zuen bere taula periodikoa, eta, ia aldi berean, Julius Lothar Meyerrek antzera egin zuen 1870ean. Mendeleyeven mahaia izenaz argitaratu zen lehen bertsioa. Biek ala biek taula periodikoa antzeko moduan proposatu zuten: elementuak zutabetan eta errenkadetan sailkaturik pisu atomikoen arabera. Errenkada edo zutabe berriak egin zituzten elementuen ezaugarriak errepikakorrak suertatzen zirenean. Handik gutxira, 1871an, Mendeleievek beste taula periodiko bat argitaratu zuen, baina, oraingoan, antzekoak ziren elementuen multzoak errenkadatan sailkatuta egon ordez, zutabetan zeuden banaturik. Gainera, oraindik aurkitu gabe zeuden elementuen deskribapen zehatza eskaini zuen. Hutsune haiek gerora beteko zirela iradoki zuen, kimikariek elementu natural berriak aurkitzean. Gauzak horrela, Mendeleieven lanaren onarpena bi arrazoi nagusiengatik gertatu zen: batetik, Mendeleievek hutsuneak utzi zituelako taulan aurkitu gabeko zeuden elementuentzat eta, bestetik, alde batera utzi zuelako ordura arte erabiltzen zen sailkatze-ordena, taula pisu atomikoen arabera antolatuz.
Dena den, 1913. urtean, Henry Moseleyk, elementu bakoitzari zenbaki atomiko bat esleitu zion, eta, horren ondorioz, zuzenketa bat egin behar izan zen taulan; izan ere, Mendeleievek pisu atomikoa erabili zuen elementuen sailkapena egiteko, eta horrek arazoak sortzen zituen. Hortaz, Moseleyren zehaztapenaren ondoren eta arazo horiek konpontzeko, zenbaki atomikoaren arabera berrantolatu zen taula.
Gaur egun ezagutzen dugun taularen egituraketa Horace Groves Demingi zor diogu. Demingek 1923an argitaratutako taulan, periodo motz eta ertainak zeuden (gaurko hamazortzi zutabeak). Merc and Company enpresak Demingen taula argitaratu zuen, eta, urte horretan, Estatu Batuetako eskoletan kopiak banatu zituen, eta, 1930eko hamarkadan, entziklopedietan zabaldu zen.
Mekanika kuantikoa eta taularen hedapen progresiboa
Mendeleieven taula periodikoak zenbait irregulartasun eta problema agertzen zituen. Hurrengo hamarkadetan, gas nobleen, lur arraroen eta elementu erradioaktiboen aurkikuntzak integratu behar izan zituen. Beste arazo gehigarri bat izan zen pisu atomikoa handituz ordena-irizpidea eta propietate kimiko komunak dituzten familien arabera taldekatzearekin bateratzeko zeuden irregulartasunak. Zailtasun horren adibide dira telurio-iodo, argon-potasio eta kobalto-nikel bikoteak, zeinetan pisu atomiko handitzeko irizpidea aldatzea beharrezkoa den antzeko propietate kimikoak dituzten familietan multzokatzeko.
Zenbait denboraz, galdera hau ezin izan zen behar bezala konpondu, Henry Moseleyk (1867-1919), 1913an, X izpien espektroei buruzko ikerketa bat egin zuen arte. Moseleyk egiaztatu zuen sistema periodikoaren ordena-zenbakiaren arabera erradiazio-maiztasunaren erro karratua irudikatuz, lerro zuzen bat lortzen zela, eta, horri esker, ordena hori ez zela ustekabekoa ikustera zeraman, baizik eta egitura atomikoaren propietate batzuen isla baizik. Gaur egun badakigu propietate hori nukleoaren zenbaki atomikoa (Z) edo karga positibo kopurua dela.
XX. mendearen lehen herenean mekanika kuantikoaren teoria eraiki zenean, sortutako garapen teorikoen ondoren sortu zen gaur egun onartzen den lege periodikoaren azalpena. Ikerketa horri eta ondorengo garapenei esker, sistema periodikoko elementuen antolamendua elementu ezberdinen atomoen egitura elektronikoarekin erlazionatuta dagoela onartzen da, eta, bertatik, haien propietate kimiko desberdinak iragar daitezke[25].
1945ean Glenn Seaborg estatubatuar zientzialariak iradoki zuen ordurarte uste zenaren aurka aktinidoak eta lantanoideak d blokeko laugarren errenkadaren ordez f azpimaila betetzen ari zirela. Seaborgen lankideek hain teoria erradikala ez argitaratzeko gomendatu zioten, bere karrera hondatuko zuelako ziurrenik. Garai hartan, ospea erori zitekeen karrerarik ez zuela uste zuenez, argitaratu egin zuen hala ere. Gerora, zuzena zela ikusi zen, eta, 1951n, Kimikako Nobel Saria irabazi zuen aktinidoen sintesian egindako lanagatik[26][27][Oh 2]
1952an, Gil Chaverri Costa Ricako zientzialariak elementuen egitura elektronikoan oinarritutako bertsio berri bat aurkeztu zuen, zeinak lantanidoen eta aktinidoen serieak sekuentzia logiko batean kokatu ahal izateko zenbaki atomikoaren arabera onartzen duen[29].
Elementu transuraniko batzuen kantitate txikiak modu naturalean gertatzen badira ere[30], denak laborategietan aurkitu ziren lehenengoa, neptunioa izan zen, 1939an sintetizatua. Elementu horien ekoizpenak nabarmen hedatu du taula periodikoa[31] Asko oso ezegonkorrak direnez eta azkar usteltzen direnez, sortzen direnean, zailak dira detektatzeko eta karakterizatzeko. Elementu batzuen erreklamazioen eta aurkikuntza-eskubideen onarpenari buruzko eztabaidak egon izan dira berrikuspen independente bat eskatuz zein alderdik duen lehentasuna zehazteko eta, beraz, izenaren eskubideak. flerovio (114. elementua) eta livermorio (116. elementua) 2012ko maiatzaren 31n izendatu zituzten[32]. 2010ean, Errusiaren eta Estatu Batuen arteko lankidetza bateratu batek Dubnan, Mosku eskualdean, Errusian, esan zuen tenesoaren (117. elementua) sei atomo sintetizatu zituela[33].
2015eko abenduaren 30ean, IUPACek 113, 115, 117 eta 118 elementuak aitortu zituen ofizialki taula periodikoaren zazpigarren errenkada osatuz[34]. 2016ko azaroaren 28an, IUPACek ordura arte onartutako azken lau elementu berri horien izen eta sinbolo ofizialak iragarri zituen (Nh, nihonio; Mc, moscovio; Ts, teneso; eta Og, oganeson)[35], zeinak aldi baterako izendapenak ordezkatzen dituzten.
 Ariketak
Ariketak
- Taula periodikoa
- Taula periodikoa lantzeko ariketa.
Erreferentziak
- (Gaztelaniaz) Cornelis, Klein. ([1996]). Manual de mineralogía: basado en la obra de J. Dana. (4{487} ed. argitaraldia) Reverté ISBN 9788429146066. PMC 625153590..
- (Ingelesez) Benfey, Theodor (2009). «The biography of a periodic spiral: from Chemistry Magazine, via Industry, to a Foucalt Pendulum». Bull. Hist. Chem. 34 (2): 141-145. Noiz kontsultatua: 2016-02-08.
- (Gaztelaniaz) Atkins, Peter William. (2006). Principios de química: los caminos del descubrimiento. (3. argitaraldia) Editorial Médica Panamericana ISBN 9789500600804. PMC 78773725..
- (Gaztelaniaz) de Llata Loyola, María Dolores. (2001). Química inorgánica. Progreso ISBN 9789706413512. PMC 651588304..
- (Gaztelaniaz) Bernardo Herradón: «La química y su relación con otras ciencias» Journal of Feelsynapsis (JoF), 2011 (1). ISSN 2254-3651.
- (Ingelesez) Ham, Becky. (2008). The periodic table. Chelsea House ISBN 9781438102382. PMC 560474139..
- (Ingelesez) «IUPAC». Periodic Table of Elements (30 de noviembre de 2016). Noiz kontsultatua: 2016-11-30. «Cuatro nuevos elementos aprobados oficialmente por la IUPAC: Nh, Mc, Ts y Og.»
- (Gaztelaniaz) «La tabla periódica se completa con cuatro nuevos elementos químicos». El Mundo. 2016-01-04.
- (Ingelesez) Emsley, John. (2011). Nature's building blocks: everything you need to know about the elements. Oxford University Press ISBN 9780199605637. PMC 752819524..
- (Ingelesez) Fernel, Jean. (2003). The Physiologia of Jean Fernel (1567). American Philosophical Society ISBN 0871699249. PMC 50645654..
- (Gaztelaniaz) Jiménez, Javier (8 de febrero de 2016). «Dmitri Mendeléyev, el hombre que ordenó los elementos». Noiz kontsultatua: 2018-02-05.
- (Ingelesez) Horvitz, Leslie Alan. (2002). Eureka!: scientific breakthroughs that changed the world. J. Wiley ISBN 9780471233411. PMC 50766822..
- (Alemanez) Kekulé, Aug.. «Ueber die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale» Annalen der Chemie und Pharmacie 104 (2): 129–150. doi:. ISSN 1099-0690. (Noiz kontsultatua: 2018-03-27).
- (Ingelesez) van Spronsen, J. W.. (1969). The periodic system of chemical elements: a history of the first hundred years. Elsevier ISBN 0444407766. PMC 61773..
- Venable, pp. 85-86; 97.
- (Gaztelaniaz) Fenómenos químicos escrito por Carlos Arturo Correa Maya, Google Books.
- «An Unsystematic Foreshadowing: J. A. R. Newlands» web.lemoyne.edu (Noiz kontsultatua: 2023-09-14).
- «An Unsystematic Foreshadowing: J. A. R. Newlands» web.lemoyne.edu (Noiz kontsultatua: 2023-09-14).
- Bryson, B. (2004). A Short History of Nearly Everything (en inglés). Black Swan. pp. 141-142. ISBN 978-0-552-15174-0
- Scerri 2007, 306 orr. .
- (Ingelesez) «The Atomic Debates: "Memorable and Interesting Evenings in the Life of the Chemical Society"» Isis 56 (1): 5–25. 1965-04 doi:. ISSN 0021-1753. (Noiz kontsultatua: 2023-09-14).
- «Davy Medal | Royal Society» royalsociety.org (Noiz kontsultatua: 2023-09-14).
- Scerri 2007, 87-92 orr. .
- (Ingelesez) Kauffman, George B.. (1969-03). «American forerunners of the periodic law» Journal of Chemical Education 46 (3): 128. doi:. ISSN 0021-9584. (Noiz kontsultatua: 2023-09-14).
- Ball, 111 orr. .
- Scerri 2007, 270-271 orr. .
- Masterton, William L.; Hurley, Cecile N.; Neth, Edward J.. (2012). Chemistry : principles and reactions. Belmont, CA : Brooks/Cole, Cengage Learning ISBN 978-1-111-42710-8. (Noiz kontsultatua: 2023-09-14).
- van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. pp. 315-316, ISBN 0-444-40776-6
- «Chaverri periodic table» web.archive.org 2013-10-22 (Noiz kontsultatua: 2023-09-14).
- Emsley, John. (2011). Nature's building blocks : an A-Z guide to the elements. Oxford ; New York : Oxford University Press ISBN 978-0-19-960563-7. (Noiz kontsultatua: 2023-09-14).
- Bell, 123 orr. .
- (Alemanez) Barber, Robert C.; Karol, Paul J.; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, Erich W.. (2011-06-01). «Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)» Pure and Applied Chemistry 83 (7): 1485–1498. doi:. ISSN 1365-3075. (Noiz kontsultatua: 2023-09-14).
- «ru:Эксперимент по синтезу 117-го элемента получает продолжение» [Experiment on sythesis of the 117th element is to be continued] (errusieraz). JINR. 2012
- (Ingelesez) «Periodic table's seventh row finally filled as four new elements are added» The Guardian 2016-01-04 ISSN 0261-3077. (Noiz kontsultatua: 2023-09-15).
- «IUPAC». Periodic Table of Elements (2016ko azaroaren 30) (ingelesez). 2016-11-30ean begiratua. «Lau elementu berri IUPACek ofizoalki onartuak: Nh, Mc, Ts y Og».
Oharrak
- Garai hartan, oraindik aurkitu gabe ziren gas noble deiturikoak
- Dagoeneko 1892an, bismutoa baino pisu atomikoa handiagoa zuten elementu ezagun eta ezezagunak —torioa, protaktinioa eta uranioa, adibidez— sartzeko bigarren errenkada duen taula periodiko luzea planteatu zen. Ikertzaile gehienek, ordea, elementu horiek 3. trantsizio taldekoen antzekotzat jo zituzten: hafnioa, tantalioa eta wolframioa. Bigarren barne trantsizio serie baten existentzia, aktinidoen moduan, ez zen onartu lantanidoen egitura elektronikoekin antzekotasunak ezarri arte.[28]
Bibliografia
- Agafoshin, N. P.. (1977). Ley periódica y sistema periódico de los elementos de Mendeleiev. Editorial Reverté, Madrid, 200 or..
- Bensaude-Vicent, B. D.. (1984). ««Mendeleiev: El sistema periódico de los elementos» 42 (Mundo científico): 184-189..
- Calvo Rebollar, M.. (2019). Construyendo la Tabla Periódica. Prames, Zaragoza, 407 or..
- Chaverri Gil. (1951). «Periodic Table of the Elements» 30 (Journal of Chemical Education): 632..
- Ernsley, J. (2011). Nature's Building blocks (Oxford University Press): 699..
- Fontani, M; Costa, M; Orma, M.V.. (2014). The Lost Elements: The Periodic Table's Shadow Side. Oxford University Press, 508 or..
- Muñoz, R; Bertomeu Sanchez, J. R.. (2003). Enseñanza de las ciencias 21 (1): 147-161.. Testu osoa
- Rocke, A. J.. (1984). Chemical Atomism in the Nineteenth Century From Dalton to Cannizzaro. Ohio. Ohio State University Press.
- Román Polo, P. (2002). El profeta del orden químico: Mendeléiev. Nivola, Madrid, 190 or..
- Scerri, E. R.. (1998). «Evolución del sistema periódico» Investigación y Ciencia, 266: 54-59..
- Scerri, E. R.. (2007). The Periodic Table: Its Story and Its Significance. Oxford University Press, 346 or..
- Strathern, Paul. (2000). El sueño de Mendeléiev, de la alquimia a la química. Siglo XXI, España Editores, Madrid, 288 or..