Prousten legea
Prousten legea, proportzio konstanteen legea edo proportzio finkoen legea, 1795ean adierazi zen lege estekiometriko bat da, Louis Proust zientzialari, kimikari eta farmazialari frantziarrak aurkitua. Proustek XIX. mendearen hasieran gauzatu zuen esperimentu bati esker dugu lege honen berri, errekuntza erreakzioak hartu zituen oinarritzat legeak diona ondorioztatzeko:
«Bi edo elementu gehiago konposatu kimiko bat edo gehiago osatzeko konbinatzen direnean, elementu horien arteko masen erlazioa beti berdina izango da».[1][2][3]
Lege hau betetzen duen konposatu orok, bere osagaitzat dituen elementuak kopuru konstantean edukiko ditu beti. Egungo formula molekularraren gaiari dagokionez, lege honi zor diogu konposatu bakoitzari jar diezazkiogun azpiindize zehatz edo finkoak. Aurretik aipatu dugu, lege hau betetzen duen konposatu orok jarraitu behar dituela neurri horiek, baina badira zenbait sustantzia, ez estekiometriko gisa deiturikoak (bertolido bezala ere ezagunak), legea betetzen ez dutenak.[4] Konposatu hauek osatzen dituzten elementuen proportzioak aldagarriak dira, nahiz eta aldakortasun horrek bere mugak izan. Horretaz gain, beste zenbait materialek, hala nola, aleazioek edo koloideek, ez dute legea betetzen, izan ere, ez dira erabateko konposatuak, nahasteak baizik. Materia gisa hartzen da, espazioan leku bat hartzen duen eta masa duen edozein gorputz. Kasu gehienetan, materia kimika analitikoaren zenbait metodo baliatuz, antzeman edo neurtu daiteke.
Adibideak

Lege honek kimikan izan ditzakeen zenbait aplikazioren inguruko adibideak daude jarraian.
Uraren eraketa
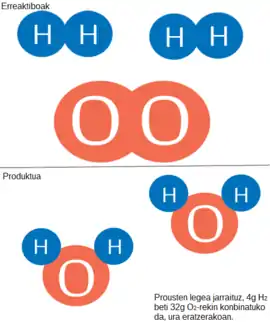
Ura eratzeko jakina da hidrogeno eta oxigenoa behar ditugula, baina proportzio zehatz batzuetan konbinatzen dira ura sortzerako orduan, Prousten legea jarraituz:
Demagun, hidrogeno gramo bat dugula. Oxigeno kopuru zehatz batekin elkartu nahi badugu, bihurketa-faktoreak baliatuz kalkulu batzuk egin beharko ditugu, oxigeno kantitate zehatzera iristeko. Azkenik, hidrogeno gramo bat, soberakinik gabe, 7.93 oxigeno gramo[Oh 1] ingururekin konbinatzen dela jakingo dugu, ura eratzeko orduan.[5] Proportzio hori beti mantenduko da eta beraz, beste edozein hidrogeno kantitate aipatutako oxigeno kopuruarekin elkartuz gero, soberakinak egongo dira. Prozesu berdina oxigenoa finkatuz burutzen badugu, ondorio berdinera helduko gara.
Karbono dioxidoaren eraketa
Karbono dioxidoa sortzeko bi elementu behar ditugu: karbonoa eta oxigenoa. Konbinazio honetan ere Prousten legea betetzen da, hau da, proportzio jakinetan eta aldagaitzetan elkartzen dira bi elementuak, lotura kobalente bidez, jarraian azalduko den bezala:
Oraingoan, lau gramo karbono ditugula suposatuko dugu eta hauek sei oxigeno gramorekin nahasteko asmoa dugula. Bi elementuen masa molarrak kontuan hartuta kalkuluak eginez, lau gramo karbono, modu zehatzean, 2.663 gramo oxigenorekin[Oh 2] (O2) konbinatzen dela jakingo dugu eta beraz, elementu horren 3.337 gramok ez dutela erreakzionatuko. Hau da, aipatutako oxigeno kopurua soberakin gisan geratuko zaigu.
Oharrak
- Bihurketa-faktoreak erabiltzen dira kalkulu hori egiteko, hidrogeno eta oxigenoaren masa molarrarekin batera. Hidrogenoaren masa molarra 1.008g/mol-ekoa eta oxigenoarena 15.9994g/mol-ekoa dela jakinda, gramo bat hidrogenorekin zenbat oxigeno konbinatuko den jakiteko hurrengoa egin behar da:
- Oxigenoaren masa molarra 15.9994g/mol-ekoa eta karbonoarena 12.0107g/mol-ekoa dela jakinda, bihurketa-faktoreak aplikatu behar dira:
Erreferentziak
- «ZT Hiztegi Berria» zthiztegia.elhuyar.eus (Noiz kontsultatua: 2018-12-01).
- «d1201014» www.euskara.euskadi.eus 2011-07-13 (Noiz kontsultatua: 2018-12-01).
- «Prousten legea - Harluxet Hiztegi Entziklopedikoa» www1.euskadi.net (Noiz kontsultatua: 2018-12-01).
- Euskal Herriko Unibertsitatea, kimika ez organiko aurreratua. 2018ko abenduaren 1ean kontsultatua.
- «Konbinazio kimikoen legeak - hiru» www.hiru.eus (Noiz kontsultatua: 2018-12-01).