Perklorato
Perkloratoa azido perklorikotik eratorritako gatza da. Kloroaren balentzia perkloratoaren molekulan izan dezakeen garaiena da (+7).
| Perklorato | |
|---|---|
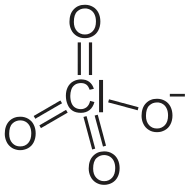 | |
| Formula kimikoa | ClO4⁻ |
| SMILES kanonikoa | [O-[Cl](=O)(=O)=O&zoom=2.0&annotate=none 2D eredua] |
| MolView | [O-[Cl](=O)(=O)=O 3D eredua] |
| Mota | monoanioi eta chlorine oxoanion (en) |
| Masa molekularra | 99,4506 Da |
| Identifikatzaileak | |
| InChlKey | VLTRZXGMWDSKGL-UHFFFAOYSA-M |
| CAS zenbakia | 14797-73-0 |
| ChemSpider | 109953 |
| PubChem | 123351 |
| Gmelin | 49706 |
| ChEBI | 2136 |
| ChEMBL | CHEMBL1161634 |
| EC zenbakia | 623-712-9 |
| ECHA | 100.152.366 |
| UNII | VLA4NZX2P4 |
Askotariko perkloratoak daude, baina ezagunena sodio perkloratoa (NaClO4) eta amonio perkloratoa (NH4ClO4) dira. Sodio perkloratoa uretan disolbatzen den gai gotor kolorgea da. Erabiliena da, eta oxidatzaile indartsua da. Lehergaiak egiteko eta azido perklorikoa eta perkloratoak ekoizteko erabiltzen da. Kloroak balentzia positiboaz eratzen dituen gai elkartuetan egonkorrena bada ere, su hartu eta leherketa eragin dezake erreduzitzaileak, gai elkartu organikoak edo azidoak ukitzen baditu.
Erreferentziak
- Artikulu honen edukiaren zati bat Lur hiztegi entziklopedikotik edo Lur entziklopedia tematikotik txertatu zen 2011/12/27 egunean. Egile-eskubideen jabeak, Eusko Jaurlaritzak, hiztegi horiek CC-BY 3.0 lizentziarekin argitaratu ditu, Open Data Euskadi webgunean.
Kanpo-estekak
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.