Organofosforo konposatu
Konposatu organofosforikoak edo organofosforo konposatuak fosforo-karbono loturak (fosfato eta fosfito esterrak izan ezik) dituen konposatu organiko degradagarria da, batez ere, izurriteen kontrolean erabiltzen dena, ingurunean irauten duten hidrokarburo kloratuen alternatiba gisa. Organofosforoen kimika organofosforo konposatuen propietateak eta erreaktibotasuna aztertzen dituen zientzia da. Fosforoak taula periodikoko 15. taldea nitrogenoarekin eta beste elementu batzuekin partekatzen du. Nitrogeno-konposatuak eta fosforo-konposatuak antzekoak dira[1][2][3].
Organofosforo konposatuen definizioa aldakorra da, eta horrek nahasmena sor dezake. Industria- eta ingurumen-kimikan, organofosforo-konposatu batek ordezkatzaile organiko bakarra izan behar du, baina ez du P-C lotura zuzena izan behar. Beraz, intsektizida gehienak, esate baterako, malathion-ak sarritan sartzen dira konposatu klase horretan.
Oxidazio-egoera, koordinazio-zenbakia eta balentzia
Organofosforo konposatu batean, fosforo atomo baten loturak ezartzen laguntzeko, hiru zenbaki erabiltzen dira.
| NC | Sínboloak | Formula orokorra | Talde konposatuak |
|---|---|---|---|
| 1 | σ11n | R—P | Fosfinidenoak |
| 1 | σ1λ3 | R—CP | Fosfoalkinoak |
| 2 | σ2λ3 | R2C=P—R | Fosfoalkinoak |
| 2 | σ2λ3 | RO—P=O | Oxofosfinoak |
| 2 | σ2λ3 | R—P=S | Tioxofosfinoak |
| 2 | σ2λ3 | R—N=P | Iminofosfinoak |
| 2 | σ2λ3 | R—P=P—R | Difosfenoak |
| 2 | σ2λ2 | R2P+ | Kation fosfenioa |
| 3 | σ3λ3 | R3P | Fosfinak |
| 3 | σ3λ3 | R—PX2 | Dihaluro alkilfosfonosoa |
| 3 | σ3λ3 | R2P—X | Dialkilfosfino haluroa |
| 3 | σ3λ3 | R—P(OR)2 | Dialkilfosfonitoa |
| 3 | σ3λ3 | (RO)3P | Trialkilfosfitoa |
| 3 | σ3λ5 | R—PO2 | Dioxofosforanoak |
| 3 | σ3λ5 | RO—PO2 | Alkilmetafosfatoa |
| 3 | σ3λ5 | R—P(O)(=CH2) | Metilenoxofosforanoa |
| 3 | σ3λ5 | R—P(=CR2)2 | Bis(metilen)fosforanoa |
| 4 | σ4λ4 | R4P+ | Ion fosfonioa |
| 4 | σ4λ5 | R—P(O)(OH)2 | Azido fosfonikoa |
| 4 | σ4λ5 | R2—P(O)(OH) | Azido fosfinikoa |
| 4 | σ4λ5 | R3—P(O) | Fosfina oxidoa |
| 4 | σ4λ5 | RO—P(O)(OH)2 | Alkilfosfatoa |
| 4 | σ4λ5 | (RO)2P(O)(OH) | Dialkilfosfatoa |
| 4 | σ4λ5 | (RO)3P(O) | Trialkilfosfatoa |
| 5 | σ5λ5 | R5P | Fosforanoak |
| 6 | σ6λ6 | R6P- | Izen arruntik gabea |
Oxidazio-egoera edo oxidazio- zenbakia: lotura ionikoen eredu batean, arauak aplikatu ondoren atomo bakoitzean geratzen den karga ionikoa da[4], partekatutako elektroi bikoteak atomo elektronegatiboenei esleitzen dizkietenak[5]. Fosforoak hainbat oxidazio-egoera har ditzake, eta ohikoa da organofosforo konposatuak sailkatzea (V) fosforoaren edo (III) fosforoaren deribatuak diren kontuan hartuta, horiek baitira fosforo-konposatuen klase nagusiak.
IUPACen ordezkapen nomenklaturan, oraindik gutxi erabiltzen den nomenklatura deskribatzailean, λ (lambda) konbentzioa erabiltzen da lotura-zenbaki estandarra ez duten fosforoaren eta beste elementu batzuen konposatuak izendatzeko. Ondoan, σ koordinazio-zenbakia erabiltzen da.
Koordinazio-zenbakia, sigma σ hizki grekoaz goi-indize batekin adierazten dena, atomo zentrala zuzenean lotzen den atomo-kopurua da, edo atomo zentralak eratzen duen σ-loturen kopurua[6]. Fosforoaren δ koordinazio-zenbakia 1 eta 6 artean alda daiteke.
Lambda konbentzioan, elementu baten eta bere ondoko atomoen arteko n lotura-kopuru osoa λn bezala adierazten da, λ balentzia deritzona. λ5 fosfano ikurrak fosforoak bost hidrogenorekin lotzen duela adierazten du; hau da, λ ikurra fosforoak balentzia-egoera ez-estandarra duela adierazteko erabiltzen da (estandarra 3 da), eta goi-indizeak bost hidrogeno-lotura adierazten ditu.
Sistema horretan, fosfina edo fosfanoa σ3λ3 konposatua da. σmλn konposatu batean, fosforo atomoa m atomoekin lotuta dago guztira n loturaren bidez.
Organofosforo konposatuen sailkapena, koordinazio zenbakian oinarrituta
Eskuineko taulan organofosforo konposatuen talde desberdinak ageri dira, haien koordinazio-zenbaki ezberdinaren (NC) eta bere lambda balentzia, λ.
Fosforoaren oinarrizko oxoazido mononuklearrak
| Formula | Izen kimikoa | deribatu organikoak |
|---|---|---|
| (HO) 3P | azido fosforotsua | fosfitoak |
| (HO) 2 HP | azido fosfonikoa | fosfonitoak |
| (HO) H2P | azido fosfinosoa | fosfinitoak |
| (HO)PO | Azido metafosforoa edo fosfenoa | metafosfitoak |
| (HO) 3PO | azido fosforikoa | fosfatoak |
| (HO) 2HPO | azido fosfonikoa | fosfonatoak |
| (HO) H2PO | Azido fosfinikoa edo hipofosforosoa | fosfinatoak |
| (HO) PO2 | Azido metafosforikoa edo fosfenikoa | metafosfatoak |
H-organofosfatoen tautomerismoa
H-organofosfatoak fosforo-atomo zentralari zuzenean lotuta dauden hidrogeno atomoa duten organofosfatoak dira. P-H lotura horrek propietate kimiko bereziak ditu. Familia horretako lehen talde aztertuena fosfitoak dira, zeinetan atomo zentrala tribalentea den, eta, nahiz, hasieran batez ere, fosfito forma tautomerotan zeudela uste izan, hamarkadetan, ondo finkatuta dago konposatu horien gehiengo zabalak nahiago dituela H-fosfonato motako egiturak atomo fosforo pentabalentedunekin[7]:

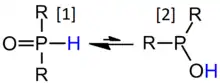
Ezagutzen diren dialkilo organofosfato guztien infragorrien espektroek, batenak izan ezik, P=O eta PH loturen luzapenari dagozkion xurgapen sendoak erakusten dituzte, eta, R=R'=OH-rentzat izan ezik, ez dute OH luzapenaren ezaugarri berezirik erakusten! Bis(trifluorometil) konposatua (R=R'=CF3) baino ez dago, gaur egun, fosfito tautomero gisa[8].
Nahiz beste fosfonato guztien (R= R'= alkoxi), fosfinatoak (R= alkoxi; R'= alkil, arilo) eta fosfina oxido sekundarioak (R=R'= alkilo, arilo) tautomero oxiazidoak zuzenean ikusi ez arren, erreakzio-mekanismo askok 1 ↔ 2 tautomerizazioa eskatzen dute, zeinak, literatura kimikoan, askotan agertu diren. Esaterako, dialkilfosfonatoen zilar metal alkaliko gatzek ez dute, infragorrian, P=O luzatze-bandarik erakusten, eta horrek benetan adierazten duena da fosforo azidoaren deribatuak direla eta dagozkien dialkilfosfonatoetatik prestatzea (Michaelis-Becker erreakzioaren lehen urratsa) tautomero oxiazido ezegonkorraren esku hartzea eskatzen duela[9].
Karbonoaren lotura kimikoak beste atomoekin
| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | ||
| Fr | CRa | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||
| ↓ | ||||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | ||||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | ||||
| Oinarrizko kimika organikoa. | Erabilera asko kimikan. |
| ikerketa akademikoa, baina ez oso erabilia. |
Lotura ezezaguna / Baloratu gabea. |
Erreferentziak
- Dillon, K. B.; Mathey, F.; Nixon, J. F. Phosphorus. The Carbon Copy; John Wiley & Sons, 1997. ISBN 0-471-97360-2
- Quin, L. D. A Guide to Organophosphorus Chemistry; John Wiley & Sons, 2000. ISBN 0-471-31824-8
- Racke, K.D., 1992. Degradation of organophosphorus insecticides in environmental matrices. In: Chambers, J.E., Levi, P.E. (Eds.), Organophosphates: Chemistry, Fate, and Effects. Academic Press, San Diego, pp. 47–73.
- Principios básicos de química. Harry B. Gray, Gilbert P. Haight. Editorial Reverteé, 1981. ISBN 8429172009 Pág. 5.9
- Química organometálica de los metales de transición. Robert H. Crabtree. Ediciones de la Universitat Jaume I, 1997. ISBN 8480211342 Pág. 55
- A guide to organophosphorus chemistry. Louis D. Quin. Wiley-IEEE, 2000. ISBN 0471318248 Pág. 8
- «Tautomerization of dimethyl phosphonate» J. Am. Chem. Soc 104 (13): 3594-3595. 1982 doi:..
- «THE PHOSPHINOUS ACID (CF3)2POH AND THE DIPHOSPHOXANE (CF3)2POP(CF3)2» J. Am. Chem. Soc 82 (6): 1507-1508. 1960 doi:..
- «The Structure and Properties of the Dialkyl Phosphonates» Chem. Rev. 61 (1): 31-44. 1961 doi:..
Ikus, gainera
Kanpo estekak
- Organofosforatuen kimika @ users.ox.ac.uk; @ www.chem.wisc.edu