Kimika ez-organiko
Kimika ez-organikoa substantzia kimiko guztiak, hidrokarburoak eta haien deribatuak izan ezik, eta haien propietate eta erreakzio kimikoak aztertzen dituen kimikaren alorra da. Kimika organikoak[1] karbonoa duten konposatuak biltzen dituen arren, hurrengo konposatuak ere kimika ez-organikoan sartzen dira: karbono oxidoa, karburoak, karbono disulfuroa, zianuro metalikoak eta hirugarren mailako beste konposatu batzuk, besteak beste, karbonilo metalikoak, fosgenoa (), karbonato metalikoak eta abar. Ez da erabatekoa kimika organikoaren eta kimika ez-organikoaren arteko bereizketa, ez talde batekoak ez bestekoak diren gai ugari baitira, konposatu organometalikoak[2] adibidez. Aplikazioei dagokienez, kimika ez-organikoak aplikazioak ditu industria-kimikaren alor guztietan, besteak beste, katalisian, materialen zientzian, medikamentuen ekoizpenean, nekazaritzan, erregaietan eta pigmentuetan[3].
Oinarrizko kontzeptuak
Konposatu ez-organiko asko konposatu ionikoak dira, hau da, lotura ionikoz lotutako katioi eta anioiez osatutakoak. Mota honetako adibide batzuk hauexek dira: magnesio kloruroa, magnesio katioiaz eta kloruro anioiaz osatua; sodio oxidoa , sodio bi katioiez eta oxido anioiaz osatua. Edozein gatzetan, osagaien proportzioak karga totala nuloa izateko behar direnak direlarik, osagaiak neutroak izaten dira. Ioiak deskribatzeko, oxidazio-egoera izaten da kontuan, eta eratzeko erraztasuna, katioien kasuan, ionizazio-potentzialetik iragar daiteke eta, anioien kasuan, aldiz, elektroi-afinitatetik.

Kimika ez-organiko industriala
Kimika ez-organikoa zientziaren arlo oso praktikoa da. Tradizionalki, nazio baten ekonomia azido sulfurikoaren ekoizpenaren arabera ebaluatzen zen. 2005eko[4] datuen arabera, Kanadan, Txinan, Europan, Indian, Japonian eta Estatu Batuetan fabrikatutako 20 gai kimiko ez-organiko garrantzitsuenak hauek dira: aluminio sulfatoa, amoniakoa, amonio nitratoa, amonio sulfatoa, karbono beltza, kloroa, azidoa klorhidrikoa, hidrogenoa, hidrogeno peroxidoa, azido nitrikoa, nitrogenoa, oxigenoa, azido fosforikoa, sodio karbonatoa, sodio kloratoa, sodio hidroxidoa, sodio silikatoa, sodio sulfatoa, azido sulfurikoa (1.Irudia) eta titanio dioxidoa.
Ongarrien fabrikazioa kimika ez-organiko industrialaren beste aplikazio nagusietako bat da.
Kimika ez-organiko deskriptiboa
Kimika ez-organiko deskriptiboa konposatuak haien propietateen arabera sailkatzean datza. Neurri batean, konposatuaren elementu astunak taula periodikoan duen kokapenean oinarritzen da, bertan konposatuak beren egiturazko antzekotasunen arabera multzokatzen direlarik. Konposatu ez-organikoak aztertzen direnean, horien izaeraren arabera sailkatzen dira.
Koordinazio-konposatuak

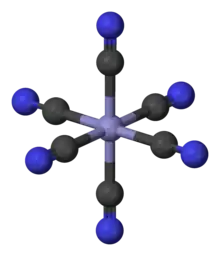
Koordinazio konposatu klasikoen artean, , , eta bezalako estekatzaileen talde nagusiko atomoetako elektroien pare bakartiei lotutako metalak daude. Koordinazio-konposatu berrietan, ia konposatu organiko eta ez-organiko guztiak erabil daitezke estekatzaile gisa. Metala normalean 3-13 taldeetakoa izaten da, baita trans-lantanidoetakoa eta trans-aktinidoetakoa ere. Oro har, konposatu kimiko guztiak koordinazio-konplexu gisa deskriba daitezke. Koordinazio-konplexuen estereokimika askotarikoa izan daiteke, Werner-ek tik bi enantiomero bereizten dituenean ondorioztatzen duen bezala; kiralitatea ez da bakarrik konposatu organikoetan gertatzen[5]. (2.Irudia) Koordinazio-konposatu baten adibidea ikus daiteke [Co(EDTA)]− dena.
Talde nagusiko konposatuak
Talde nagusiko konposatuek I, II, III, IV, V, VI eta VII taldeko elementuak dauzkate. 3. eta 12. taldeetako elementu batzuk sar daitezke, baita lantanidoak eta aktinidoak ere[6]. Azken horien erreaktibitatea antzekoa da.
Talde nagusiko konposatuak hasieratik ezagutzen dira, adibidez, sufre elementala edo fosforo zuria.
Lavoisier eta Priestley-ek -arekin egindako esperimentuak, gas diatomiko hau aurkitzeaz gain, konposatuak eta erreakzioak estekiometria-erlazioen arabera deskribatzeko bidea ireki zuten. Amoniakoaren burdin katalizatzaileen bidezko sintesia aurkitzea eragin handia izan zuen gizaterian 1900eko hamarkadaren hasieran, kimika ez-organikoko sintesiaren garrantzia agerian utzi baitzuen.
Talde nagusien konposatu tipikoak , eta dira. Talde nagusiko konposatu asko organometaliko gisa ere sailka daitezke, talde organikoak baitituzte, adibidez, B(CH3)3. Konposatu horiek naturan ere aurki daitezke, esate baterako, fosfato taldea azido nukleikoetan, eta beraz, bioinorganiko gisa sailka datitezke. Talde nagusien konposatuen artean, badaude karbono hutsean oinarritutako konposatuak. Horien adibide batzuk fullerenoa edo karbono-nanohodiak dira.
Trantsizio-metalen konposatuak
4. taldetik 11. taldera bitarteko metalak dituzten konposatuei trantsizio-metalen konposatu deritze. 3. taldeko eta 12. taldeko metalak dituzten konposatuak ere sartzen dira talde honetan, zenbait kasutan. Hala ere, talde nagusiko konposatutzat ere hartzen dira.
Trantsizio-metalen konposatuek askotariko koordinazio-kimika erakusten dute. Tetraedrikotik hasita titaniorako (-a adibidez), karratu planarreraino nikel-konplexu batzuetarako, edo oktaedrikoa, kobaltoaren koordinazio-konplexuetarako. Zenbait trantsizio-metal biologikoki garrantzitsuak diren konposatuetan aurki daitezke, esate baterako, burdina, hemoglobinan.
Konposatu organometalikoak
Edozein konposatuk, organometalikoa izateko, M-C-H lotura[7] izan behar du. Konposatu horien metala (M) talde nagusiko elementu bat edo trantsizioko metal bat izan daiteke. Konposatu organometalikoetan, konplexu oso lipofilikoak ere sartzen dira, hala nola, karbonilo metalikoak eta alkoxido metalikoak.
KKonposatu organometalikoak kategoria berezitzat hartzen dira, estekatzaile organikoak hidrolisiarekiko edo oxidazioarekiko sentikorrak izaten direlako, eta, beraz, beharrezkoa da konposatu organometaliko horietan tradizionalak diren prestakuntza-metodoak baino espezializatuagoak erabiltzea, baldintza bereziagoetan. Metodologia sintetikoak, bereziki koordinazio-potentzia txikiko disolbatzaileetan, konplexuak manipulatzeko gaitasunagatik, koordinazio-estekatzaile oso ahulak esploratzea ahalbidetu zuen, hala nola hidrokarburoak, eta .
Eta hona hemen konposatu hauen hiru adibide; , eta .
Kimika ez-organiko teorikoa
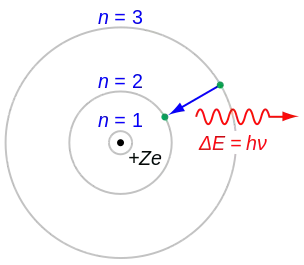
Kimika ez-organikoaren arloko ikuspegi alternatibo bat Bohr-en atomoaren ereduarekin hasten da (3.Irudia), eta kimika teorikoaren eta kimika konputazionalaren tresnak eta ereduak erabiliz, molekula sinpleen loturen eraketatik, molekula konplexuagoen loturen eraketa azaltzera zabaltzen da. Zaila da mekanika kuantikoaren dekribapen zehatzak lortzea kimika ez-organikoaren eremua osatzen duten espezie multielektronikoetarako. Erronka horrek ikuspegi erdikuantitatibo edo erdienpiriko asko eragin ditu, orbital molekularren teoria eta estekatzailearen eremuaren teoria barne hartzen dituztenak. Deskribapen teoriko horiekin batera, hurbileko metodologiak erabiltzen dira, dentsitate funtzionalaren teoria barne.
Teoria kualitatibo eta kuantitatiboen salbuespenak oso garrantzitsuak dira arlo honen garapenean. Adibidez, ia diamagnetikoa da giro-tenperaturaren azpitik, eremu kristalinoaren teoriak molekulak parekatu gabeko bi elektroi izan beharko lituzkeela iragartzen badu ere. Teoria kualitatiboaren (paramagnetikoa) eta behaketaren (diamagnetikoa) arteko desadostasunak "akoplamendu magnetikorako" ereduak garatzera eraman zuen. Hobetutako eredu horiek material magnetiko eta teknologia berrien garapena ekarri zuten.
Teoria kualitatiboak
Kimika ez-organikoak onura handia atera die teoria kualitatiboei. Teoria horiek ikasteko errazagoak dira, teoria kuantikoaren gaineko prestakuntza gutxi eskatzen dutelako.
Talde nagusiko konposatuen artean, BGEPAT teoriak edo Balentzia Geruzako Elektroi Pareen Aldarapenaren Teoriak; talde nagusiko konposatuen egiturak aurreikusten edo arrazionalizatzen ditu. Adibidez, azaltzen du zergatik den piramidala, eta -ak aldiz, t forma duen trantsizioko metaletarako. Eremu kristalinoaren teoriak konplexu sinple askoren magnetismoa ulertzea ahalbidetzen du. Adibidez, [FeIII(CN)6]-ak (4.Irudia) duen ikuspegi kualitatiboa bereziki indartsua da egitura eta erreaktibitatea ebaluatzeko, eta molekulak elektroi kopuruaren arabera sailkatzen ditu, molekula baten atomo zentraleko balentzia-elektroien kopuruari erreparatuz.
Taldeen teoria eta simetria molekularra
Kimika ez-organikoaren oinarrietako bat simetria molekularraren teoria da[8]. 11 taldeen teoriak molekulen formak deskribatzeko hizkuntza garatzen du, puntu taldeen simetriaren arabera. Taldeen teoriak kalkulu teorikoak faktorizatzeko eta sinplifikatzeko aukera ematen du.
Ezaugarri espektroskopikoak aztertzen eta deskribatzen dira, besteak beste, bibrazio-egoeren edo egoera elektronikoen simetria-propietateei dagokienez. Funtsezko egoeren eta egoera kitzikatuen simetria-propietateak ezagutzeak espektro bibrazionalen eta elektronikoen xurgapenen kopurua eta intentsitatea iragartzea ahalbidetzen du. Taldeen teoriaren aplikazio klasiko bat karbonilo metal konplexu ordezkatuetako C-O bibrazio kopuruaren iragarpena da. Simetriaren espektroskopiarako aplikazio ohikoenek espektro bibrazionalak eta elektronikoak dituzte.
Tresna didaktiko gisa, taldeen teoriak espezie desberdinen eta edo eta , loturen arteko puntu komunak eta desberdintasunak nabarmentzen ditu.
Termodinamka eta kimika ez-organikoa
Kimika ez-organikoaren ikuspegi kuantitatibo alternatiboa erreakzio-energietan zentratzen da. Ikuspegi hau oso tradizionala eta enpirikoa bada ere, oso erabilgarria da. Termino termodinamikoetan adierazitako kontzeptu orokorrek erredox potentziala, azidotasuna eta fase-aldaketak barne hartzen dituzte. Termodinamika inorganikoko kontzeptu klasiko bat Born-Haberren zikloa da, afinitate elektronikoaren moduko oinarrizko prozesuen energia ebaluatzeko erabiltzen dena. Prozesu horietako batzuk ezin dira zuzenean ikusi.
Mekanismoak kimika ez-organikoan
Talde nagusiko konposatuak eta lantanidoak
13-18 taldeetako talde nagusietako konposatuen mekanismoak normalean kimikaren testuinguruan aztertzen dira (konposatu organikoak dira taldeko konposatu nagusiak, azken finean). C, N, O eta F baino astunagoak diren elementuek zortzikotearen arauak aurreikusten dituenak baino elektroi gehiago dituzten konposatuak osatzen dituzte askotan. Horregaitik, beraien erreakzioen mekanismoak konposatu organikoenak ez bezalakoak dira.
Karbonoa baino arinagoak diren elementuek (B, Be, Li), baita Al eta Mg-ak ere, elektronikoki erregaien antzekoak diren elektroietan egitura eskasak eratzen dituzte askotan.
Elektroien urritasuna duten espezie horiek elkartze-bideen bidez erreakzionatzeko joera dute. Lantanidoen kimikak aluminioarako ikusitako kimikaren alderdi asko islatzen ditu.
Trantsizio metalen konplexuak
Trantsizioko metalak eta talde nagusiko konposatuek modu desberdinean erreakzionatu ohi dute. D orbitalek loturan duten paper garrantzitsuek eragin handia dute estekatzaileekiko ordezkapen- eta disoziazio-erreakzioetan[9].
Trantsizio mekanikoko metalen kimikaren funtsezko alderdi bat konplexuaren gaitasun zinetikoa da, ur librearen trukeak ilustratua eta konplexu prototipikoetan lotua :
Aurreko erreakzioan, formulak isotopoekin aberastutako ura adierazten du. Ura trukatzeko tasak 20 magnitude-ordenatan aldatzen dira taula periodikoan, lantanidoen konplexuak mutur batean eta Ir (III) espezieak, mantsoenak, bestean.
Erredox erreakzioak
Erredox erreakzioak nagusi dira trantsizio-elementuetan. Bi erredox erreakzio mota hartzen dira kontuan: atomoen transferentzia-erreakzioak, hala nola oxidazio-adizioa eta erredukzio-ezabaketa eta elektroien transferentzia. Oinarrizko erredox erreakzioa "auto-konbinaketa" da, oxidatzaile baten eta erreduktore baten arteko erreakzio endekatua dakarrena. Adibidez, permanganatoak eta manganatoak, elektroi baten erredukzioaren ondorioz eratorriak, elektroi bat trukatzen dute:
Estekatzaileen arteko erreakzioak
Estekatzaile koordinatuen erreaktibotasuna ez da estekatzaile askeena bezalakoa. Adibidez, -ko amoniako-estekatzaileen azidotasuna handiagoa da NH3-arena baino. Katioi metalikoei lotutako alkenoak erreaktiboak dira nukleofiloen aurrean; alkenoak, aldiz, normalean ez dira erreaktiboak. Katalisi-eremua handia eta industrialki garrantzitsua da, eta estekatzaile organikoen erreaktibotasuna aldatzeko metalen gaitasunean oinarritzen da. Katalisi homogeneoa disoluzioan gertatzen da, eta katalisi heterogeneoa, ordea, gas-substratuek edo disolbatuek solidoen gainazalekin elkarreragiten dutenean gertatzen da. Tradizionalki homogeneoa den katalisia kimika organometalikoaren parte dela onartzen da, eta katalisi heterogeneoa gainazalen zientziaren testuinguruan eztabaidatzen da, egoera solidoaren kimikaren azpieremu batean. Baina oinarrizko kimika ez-organikoaren printzipioak berdinak dira. Trantsizioko-metalek ia bakarrik erreakzionatzen dute molekula txikiekin, hala nola: , , eta . Lehengai horien industriarako garrantziak berez eragiten du katalisiaren eremua. Estekatzaileek ere izan ditzakete transferentzia-erreakzioak, hala nola transmetalazioa.
Konposatu ez-organikoen karakterizazioa
Elementu askoren eta horien eratorrien propietateak direla eta, kimika inorganikoa lotuta dago analisi-metodo askorekin. Metodo zaharrenek propietate orokorrak aztertzeko balio dute, hala nola soluzioen eroankortasun elektrikoa, fusio-puntuak, disolbagarritasuna edo azidotasuna. Teoria kuantikoaren etorrerarekin eta ekipo elektronikoei dagokien hedapenarekin, tresna berriak sortu dira molekula inorganikoen eta solidoen propietate elektronikoak probatzeko. Neurketa horiek informazio garrantzitsua ematen dute eredu teorikoetarako. Adibidez, metanoaren espektro fotoelektronikoan egindako neurketek frogatu zuten balentzia-loturaren teoria erabiliz karbonoaren eta hidrogenoaren artean aurreikus daitezkeen bi zentroren eta bi elektroiren loturen bidezko loturaren deskribapena ez dela egokia ionizazio-prozesuak modu errazean deskribatzeko. Ekarpen horiek orbital molekularren teoria erabat ez-lokalizatutako orbital gisa ezagutaraztea eragin zuten, eta elektroien galera edo eszitazioaren deskribapen sinple egokiagoa dira.
Teknika ohikoenak:
- X izpien kristalografia: teknika honen bidez egitura molekularrak 3D-tan zehaztu daitezke.
- Polarizazio dualeko interferometroa: molekulen konformazioa eta konformazio-aldaketa neurtzen ditu.
- Elektrokimika: voltametria ziklikoa eta harekin lotutako teknikek konposatuen erredox ezaugarriak detektatzen ditu.
Zenbait espektroskopia mota:
- Ultramore-ikusgai espektroskopia: konposatu ez-organiko asko koloredunak direnez, teknika oso erabilia izan da.
- Erresonantzia magnetiko nuklear (EMN) espektroskopia: konposatuaren propietateei eta egiturari buruzko informazio garrantzitsua ematen du. Protoiaren EMN garrantzitsua da, hidrogenoaren nukleo arina ez baita erraz hautematen X izpien kristalografiaren bidez.
- Infragorri espektroskopia: batez ere estekatzaile karbonilikoen xurgapenetarako.
- Erresonantzia nuklear elektroniko bikoitzeko espektroskopia (ENDOR).
- Mössbauer espektroskopia.
- Spin elektronikoaren erresonantzia: zentro metaliko paramagnetikoen ingurunea neurtzeko aukera ematen du.
Erreferentziak
- Sánchez, Eva Casado (2012-07). OPERACIONES BÁSICAS LABORATORIO GM 12 CF. Editorial Paraninfo. ISBN 9788497328852. Consultado el 6 de febrero de 2018.
- Douglas, Bodie Eugene; Alexander, John J. (1994). Conceptos y modelos de química inorgánica. Reverte. ISBN 9788429171532. Consultado el 6 de febrero de 2018.
- «Careers in Chemistry: Inorganic Chemistry». American Chemical Society. Archivado desde el original el 29 de octubre de 2012.
- "Datos y cifras de la industria química" Noticias de química e ingeniería , 10 de julio de 2006.
- Lehn, J.M. (1995). Supramolecular Chemistry: Concepts and Perspectives. Weinheim: VCH. ISBN 978-3-527-29311-7.
- Neill, Greenwood, N. N. (Norman (1997). Chemistry of the elements (2nd ed edición). Butterworth-Heinemann. ISBN 0750633654. OCLC 37499934. Consultado el 27 de marzo de 2019.
- Elschenbroich, C.; Salzer, A. (1992). Organometallics: A Concise Introduction (2nd edición). Weinheim: Wiley-VCH. ISBN 978-3-527-28164-0.
- Cotton, F.A. (1990). Chemical Applications of Group Theory (3rd edición). New York: John Wiley & Sons. ISBN 978-0-471-51094-9.
- R.G. Wilkins (1991). Kinetics and Mechanism of Reactions of Transition Metal Complexes (2nd edición). Wiley-VCH. ISBN 978-3-527-28389-7.
- Artikulu honen edukiaren zati bat Lur hiztegi entziklopedikotik edo Lur entziklopedia tematikotik txertatu zen 2011/12/27 egunean. Egile-eskubideen jabeak, Eusko Jaurlaritzak, hiztegi horiek CC-BY 3.0 lizentziarekin argitaratu ditu, Open Data Euskadi webgunean.
- Operaciones básicas de laboratorio. Paraninfo 2012 ISBN 978-84-9732-885-2. PMC 810116655. (Noiz kontsultatua: 2020-12-14).
- Douglas, Bodie E.. (D.L. 1987). Conceptos y modelos de química inorgánica. (2a. ed. argitaraldia) Reverté ISBN 84-291-7153-3. PMC 435383347. (Noiz kontsultatua: 2020-12-14).
- «Studies in Inorganic Chemistry» The Chemistry of Inorganic Ring Systems (Elsevier): II. 1992 ISBN 978-0-444-88933-1. (Noiz kontsultatua: 2020-12-14).
- Anaya Durand, Alejandro. (2018-08-31). «Experiencias de la inclusión de un curso termianl de Ingeniería de Proyecto en la licenciatura de Ingeniería Química» Educación Química 5 (3): 172. doi:. ISSN 1870-8404. (Noiz kontsultatua: 2020-12-14).
- Lehn, J.-M. (Jean-Marie). (1995). Supramolecular chemistry : concepts and perspectives : a personal account built upon the George Fisher Baker lectures in chemistry at Cornell University [and Lezioni Lincee, Accademia nazionale dei Lincei, Roma. ] VCH ISBN 3-527-29312-4. PMC 32350056. (Noiz kontsultatua: 2020-12-14).
- Greenwood, N. N. (Norman Neill),. Chemistry of the elements. (2nd ed. argitaraldia) ISBN 0-585-37339-6. PMC 48138330. (Noiz kontsultatua: 2020-12-14).
- Elschenbroich, Christoph, 1939-. (1992). Organometallics : a concise introduction. (2nd, rev. ed. argitaraldia) VCH ISBN 3-527-28165-7. PMC 25048653. (Noiz kontsultatua: 2020-12-14).
- Cotton, F. Albert (Frank Albert), 1930-2007.. (1990). Chemical applications of group theory. (3rd ed. argitaraldia) Wiley ISBN 0-471-51094-7. PMC 19975337. (Noiz kontsultatua: 2020-12-14).
- Wilkins, Ralph G., 1927-. (1991). Kinetics and mechanism of reactions of transition metal complexes. (2nd thoroughly rev. ed. argitaraldia) VCH Publishers ISBN 3-527-28253-X. PMC 24065896. (Noiz kontsultatua: 2020-12-14).