Hipobromito
Hipobromito ioia BrO− formulako ioia da non bromoa +1 oxidazio-egoeran dagoen. Ioiaren gatzei ere esaten zaie hipobromito.
| Hipobromito | |
|---|---|
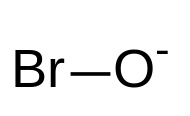 | |
| Formula kimikoa | BrO⁻ |
| SMILES kanonikoa | [O-Br&zoom=2.0&annotate=none 2D eredua] |
| MolView | [O-Br 3D eredua] |
| Azido konjokatua | azido hipobromoso |
| Mota | hypohalite (en) |
| Masa molekularra | 94,913252 Da |
| Identifikatzaileak | |
| InChlKey | JGJLWPGRMCADHB-UHFFFAOYSA-N |
| CAS zenbakia | 14380-62-2 |
| ChemSpider | 4574121 |
| PubChem | 5460626 |
| Gmelin | 29250 |
| ChEBI | 1040 |
Hipobromitoak hipokloritoaren moduan jokatzen du eta ondorioz desinfektatzaile gisa erabiltzen da[1].
Prestakuntza
Hipobromitoa prestatzeko hidroxido alkalino baren ur-disoluzioari bromoa eransten zaio. Bromuro eta hipobromito ioiak eratzen dira. Erreakzio azkarra da 20 °C-tan.
Br2 + 2 OH−(aq) → Br− + BrO− + H2O
Erreakzio honetan bromoa dismutatu egiten da (oxidazioa eta erredukzioa gertatzen zaio aldi berean) 0 oxidazio-egoeratik (Br2) -1 oxidazio-egoerara (Br-) eta +1 oxidazio-egoerara (BrO-). Sodio hidroxidoa baliatzen bada, sodio hipobromitoa isola daiteke kolore laranjako solido moduan.
Albo-erreakzio bat gertatzen da, zeinetan hipobromitoa espontaneoki bromurora eta bromatora (+5 oxidazio-egoera) dismutatzen den. 20 °C-tan azkar gertatzen da, baina 0 °C-tan mantsotu egiten da. Hortaz, tenperaturaren bidez kontrola daiteke dismutazioaren neurria.
3 BrO− → 2 Br− + BrO−
Erreferentziak
- Kneen, W. R.. (1972). Chemistry: facts, patterns, and principles. Addison-Wesley ISBN 0-201-03779-3. PMC 662457. (Noiz kontsultatua: 2021-03-21).
Ikus, gainera
- Bromuro
- Bromito
- Bromato
- Perbromato