Hidrogeno espektroaren serieak
Hidrogeno atomo bat, bere nukleoaren inguruan orbitatzen duten elektroiez osatuta dago. Elektroiaren eta nukleoan dauden protoien artean eragindako indar elektromagnetikoak eragiten du elektroa energia-maila desberdinetan aurkitzea, bakoitza bere energiarekin. Maila horiek hidrogeno atomoaren Bohr-en ereduarekin izan ziren ikusgarri nukleoaren inguruko orbita gisa. Orbita horietako bakoitzari n zenbaki oso bat dagokio. Bohr-en eredua, beranduago, mekanika kuantikoak ordezkatu zuen eta honen arabera elektroi bakoitzak orbital atomiko bat hartzen du, orbital bakoitzean duen energia aurreko teoriaren berdinetik mantenduz.
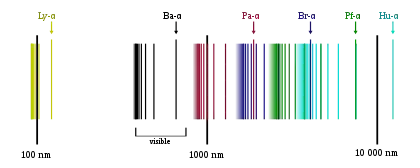
Fisika
Hidrogeno atomo baten egitura zehatza da: elektroia nukleoaren inguruan dauden orbitetan zehar higitzen dira. Orbita desberdinen sailkapena ematen da elektroien eta nukleoan diren protoiek arteko indar elektromagnetikoaren ondorioz, energia desberdinekin.
Espektroaren igorpena elektroiaren trantsizioari edo “saltoari” esker sortzen da, energia handiko energia-mailatik txikiagoko mailara. Definizioz energia gutxieneko maila n’ adierazten da eta energia handiko maila n. Bi mailen artean gertatzen den trantsizio horretan, fotoi bat igortzen da eta hori gertatzean bi orbiten energiak finkoak direnez (beraz energien arteko aldea ere), haien artean gertatzen den trantsizio guztiek sortzen dute energia bereko fotoia.
Hidrogenoaren espektro deritzo, beraz, hidrogenoak igorritako uhin elektromagnetikoari. Solidoek igorritako espektroa jarraia den arren, atomoen igorpen eta xurgapen espektroak ez dira jarraiak. Uhin elektormagnetikoak gas monoatomikoa zeharkatu ondoren, prisma batekin batera pantaila bat jarriz gero, honetan jasoko den espektroan hainbat lerro faltako dira. Horrek xurgapen espektroa izena hartuko du.
Moldatuz eta gas monoatomikoa duen ontziaren inguruan beste pantaila jarriz, honek jasoko duena izango da atomoek igorritako erradiazioa eta honi igorpen espektroa deritzo.
Bi espektro hauek erlazionatuta daude nolabait: xurgapen espektroan falta diren lerro horiek igorpen espektroan agertuko dira, nahiz eta alderantzizko erlazioa ez den beti betetzen.
Bohr-en eredua
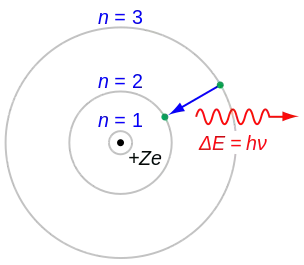
Hidrogeno atomoa oso garrantzitsua izan da fisika kuantikoaren garapenean.
Hidrogeno atomoaren espektroaren maiztasuna kalkulatu zuen eredu bat proposatuz (Bohrren eredua).
- Horrelako orbita batzuetan egonda elektroiak ez du erradiaziorik ez igorriko ez eta xurgatuko ere.
- Elektroiak energia xurgatu edo igorriko du orbita diskretu horien artean batetik bestera salto egiten badu.
- Elektroiaren momentu angeluarra kuantizatuta dago adierazpen honen bidez:
Atomo hidrogenoidea
Bohr-en eredua zehazki atomo hidrogenoidean zuzena da Z zenbaki atomikoa 1 delako, hau da, protoi bakarra eta elektroi bakarra duten atomoak direlako: H, He+, …
Rutherford-en eredu atomikoari jarraituz, atomoaren nukleoaren masa elektroiaren masa baino askoz handiagoa dela kontsideratzen da eta hortaz, atomoa pausagunean dagoela onartu, honek kalkuluak erraztuz.
Bohr-ek suposatu bezala, protoiaren eta elektroiaren arteko elkarrakzioak indar Coulombdarrak dira eta orbitak zirkularrak direnez, ondoriozta daiteke elektroiak duen azelerazioa zentripetua dela.
Coulomb-en legea eta Newtonen legea aplikatuz:
Bestalde, Bohr-en postulatua kontuan izanda, momentu angeluarra kuantizatuta dagoela adierazi:
Bi ekuazioetatik:
non Å
Hidrogeno atomoan, Z=1 denez, orbiten inguruan atera daitekeen informazioa hau da:
- Orbita zirkular baliagarrien erradioak kalkulatzeko erabiliko den adierazpena: Å
- Bohr-en erradioa, atomo honen lehenengo orbitarena izango da (n=1), oinarrizko orbita hain zuzen ere.
Abiaduraren kuantizazioan Bohr-en postulatua aplikatuz:
Energia ere kuantizatuta:
Hau kontuan izanda, oinarrizko energia (n=1) izango da:
Egoera horretan aurkitzean, elektroiak v0= 2,2 106 m/s-ko abiadura izango du.
Elektroiak energia mailetan zehar saltoak egitean, fotoia igorri edo xurgatuko du eta fotoi horren uhin-luzera kalkulatzeko hurrengoa erabiliko da:
non den (Rydberg-en konstantea).
Giro tenperaturan, atomo guztiak oinarrizko egoeran daude (oinarrizko abiadura eta energiarekin). Beraz, atomoak kitzikatzean hasierako egoera n=1 izango da, bukaerako amaiera edozein izan daitekelarik fotoiaren maiztasuna egokia baldin bada.
Giro tenperaturako xurgapen espektroa m=1 eta n arteko trantsizio espektroa izango da eta igorpen espektroa neurtzeko lehenengo atomoa kitzikatu behar da korronte elektrikoa erabiliz. Orduan, elektroiak m=1 mailatik n mailara pasako dira eta ondoren deskitzikatu egiten dira atomoak. Prozesu horretan, hasierako maila berberera itzuli daiteke edo beste maila batera joan daiteke, oinarrizko egoerara bueltatu baino lehen. Atomoa deskitzikatzen denean fotoiak igorri egiten dira trantsizioaren arabera. n mailatik berriro m=1 mailara pasatzen bada, orduan xurgapen eta igorpen espektroak berdinak izango dira eta aldiz n mailatik m desberdin batera pasatzen bada elektroia, m maila 1 eta n artean egonda, 2 trantsizio egingo ditu eta hortaz 2 fotoi igorri.
: Trantsizio honi dagokion fotoia ez da xurgapen espektroan agertuko, hasieran atomoa kitzikatu baino lehen maila horretan elektroitik ez zegoelako.
Atomo kopurua oso handia denean, trantsizio asko ikus daitezke eta atomoak deskitzikatzean dauden trantsizio aukera anitzak behatuz ondoriozta daiteke igorpen espektroa xurgapen espektroa baino aberatsagoa dela. Balmerren seriea izan zen aurkitu zen lehenengoa eta honen ondoren beste batzuk ere deskubritu ziren.
Rydberg-en formula
1880an, Rydbergek metal alkalinoen lerro espektralen uhinen arteko erlazioa deskribatzen duen formula bat landu zuen. Lerroak serieka zetozela ohartu zen, eta bere kalkuluak sinplifikatu zitzakeela ohartu zen, uhin zenbakia erabiliz (bektore unitatea okupatzen zuen uhin kopurua, 1/, uhinaren alderantzizkoa) bere neurketa-unitatea bezala. Serie bakoitzean hurrenez hurreneko lerroen uhin zenbakiak (n) landu zituen, serie partikular hartako lerroen ordena adierazten zuten elkarren segidako zenbaki osoak erabiliz. Ondoren, zetozen kurbak ere antzeko formakoak zirela ohartzean, funtzio bakar bat bilatu zuen.
Lehenengo eta behin, formula hau probatu zuen: non n lerroaren uhin zenbakia den, seriearen muga den, m lerroaren zenbaki erregularra seriean, m´ seriea serie desberdinetarako ezberdina da eta konstante unibertsala da. Honek ez zuen ongi funtzionatu Balmer-ek hidrogenoaren espektroa zela jakin zuenean, eta dena berridatzi zuen, bezala. Ekuazio honetan, m seriearen zenbaki ordinala da eta B konstantea.
Honek iradokitzen zuen hidrogenorako Balmer formula kasu berezi bat izan zitekeela m´=0 eta non den, Balmerren konstante elkarrekintza.
terminoa elementu guztien arteko konstante orokorra dela ikusi da, -ren berdina. Konstante hori Rydberg konstantea bezala ezagutzen da gaur egun eta m´ akats kuantikoa bezala ezagutzen da.
Niels Bohr-ek esan bezala emaitzak uhin zenbakian adieraztea, uhin-luzeran aderazi beharrean, Rydbergen aurkikuntzaren gakoa izan zen. Gidarien funtsezko papera 1908ko Rydberg-Ritz konbinazio-printzipioak ere azpimarratu zuen. Horretarako oinarrizko arrazoia mekanika kuantikoan datza. Argiaren uhin-zenbakia maiztasunarekiko proportzionala da, eta beraz, baita argiaren energia kuantikoarekiko ere, hurrengo konbinaketa lortuz: . Rydberg-en aurkikuntzak lerro espektralen portaeraren sinpletasuna islatzen du, atomoetako orbital elektroien arteko energia-diferentzia finkoen (kuantitatiboen) arabera.
1888ko Rydberg-en adierazpen klasikoak serie espektralaren formari buruzko azalpen fisikorik ez zuen ekarri.
Bohrren atomoaren kontzeptuan, Rydberg-en (eta Balmer-en) zenbaki osoak elektroi orbitalak irudikatzen ditu atomotik distantzia ezberdinetan. -etik -ra igarotzean emititzen den energia espektrala (edo frekuentzia), elektroi batek 1 orbitaletik 2 orbitalera salto egiten duenean igorritako edo xurgatutako fotoiak duena izango da.
Beranduago, eta balioak bi orbitalen zenbaki kuantiko nagusiekin lotzen zirela ikusi zen.
Hidrogeno atomoa
erradiazio elektromagnetikoaren uhin-luzera da, hutsarteetan emititzen dena
elektroiaren trantsizioan hasierako maila da
elektroiaren trantsizioan amaierako maila da.
Rydberg konstantea hidrogenorako, gutxi gorabehera 1.0967583
Kontuan eduki behar da .
=1 balioa hartuz eta -ri 2tik gorako balioa emanez, Lyman-en serietik abiatuz hurrengo serie mota ezberdinak lortuko ditugu:
| n1 | n2 | Izena | Espektro elektromagnetikoa |
| 1 | Lyman-en serieak | 91.13 nm (Ultramorea) | |
| 2 | Balmer-ren serieak | 364.51 nm (Argi ikusgaia) | |
| 3 | Paschen-en serieak | 820.14 nm (Infragorria) | |
| 4 | Brackett-en serieak | 1458.03 nm (Infragorri urruna) | |
| 5 | Pfund-en serieak | 2278.17 nm (Infragorri urruna) | |
| 6 | Humphreys-en serieak | 3280.56 nm (Infragorri urruna) |
Serieak
Atomoen xurgapen eta igorpen espektroak erlazionatuta daude, hau da, lehenengoan falta diren lerroak bigarrenean agertuko dira. Alderantzizkoa aldiz, ez dela egia esan genezake xurgapen esprektroan ez direlako falta igorpen espektroan dauden lerro guztiak. Aurrerago aipatu den Rydberg-en ekuazioan oinarrituz hainbat serie lortu ahal dira.
Lyman-en seriea (n'=1)
Bohr ereduan, Lyman serieak elektroiak n>1 zenbaki kuantikoko kanpoaldeko orbitatik n’=1 zenbaki kuantikoaren 1.orbitara igorritako lerroak barne hartzen ditu. Theodore Lymanek 1906 eta 1914 urteen artean espektro lerroak aurkitu zituen, eta horregatik serieak bere izena hartzen du.
Lyman serieko uhin-luzera guztiak ultramore-bandan daude eta gainera giro tenperaturan neurtzen den espektroa da[1][2].

| n | λ hutsean (nm) |
| 2 | 121.57 |
| 3 | 102.57 |
| 4 | 97.254 |
| 5 | 94.974 |
| 6 | 93.780 |
| ∞ | 91.175 |
Balmerren seriea (n'=2)
Balmer serieak edo fisika atomikoko Balmer lerroak, hidrogeno atomoaren emisio espektralak deskribatzen dituen sei serietako bat da. Balmer seriea n≥3-tik n=2-ra igarotzen den elektroiaren ezaugarria da, non n elektroiaren zenbaki kuantiko erradialari edo zenbaki kuantiko nagusiari erreferentzia egiten dion. Trantsizioak greziar hizkiz sekuentzialki izendatzen dira: n=3-tik n=2-ra H-α deitzen da, 4-tik 2-ra H-β da, 5-etik 2-ra H-Y da eta 6-tik 2-ra H-σ da. Serie honi lotutako lehen lerro espektralak espektro elektromagnetikoaren zati ikusgarrian daudenez, lerro hauek historikoki ‘H-alpha’, ’H-Beta’, ‘H-gamma’ eta abar deitzen dira non H hidrogeno elementua den[3]. Adibidez, H-alfa astronomian hidrogenoaren presentzia hautemateko erabiltzen den lerro garrantzitsua da.

| n trantsizioa | Izena | λ airean (nm) | Energia aldea (eV) | Kolorea |
| 3 | H-α | 656.279 | 1.89 | Gorria |
| 4 | H-β | 486.135 | 2.55 | Urdin argia (‘Aqua’) |
| 5 | H-γ | 434.0472 | 2.86 | Urdina |
| 6 | H-δ | 410.1734 | 3.03 | Morea |
| 7 | H-ε | 397.0075 | 3.13 | Ultramorea |
| 8 | H-ζ | 388.9064 | 3.19 | Ultramorea |
| 9 | H-η | 383.5397 | 3.23 | Ultramorea |
| ∞ | Balmer etena | 364.6 | 3.40 | Ultramorea |

Hidrogenotik datorren argiaren espektro ikusgaiak lau uhin (410nm, 434nm, 486nm, eta 656nm) erakusten ditu, n zenbaki kuantiko nagusiak deskribatutako maila kuantikorako trantsizioan kitzikatutako egoeran dauden elektroien fotoien emisioei dagozkienak. Zenbait lerro ultramore daude, 400nm baino uhin luzeera laburragoa dutenak. Lerro hauen kopurua amaigabeko segida da, ultramorea 364,6 nm-ko muga batera hurbiltzen delarik.
Balmer seriea, Balmer formula erabiliz kalkulatzen da, non Johann Balmerrek 1885ean aurkitu zuen ekuazio enpirikoa den. Balmer konturatu zen uhin bakar batek zerikusi handia zuela argi ikusgarriaren aldean zegoen hidrogeno espektroko lerro bakoitzarekin (uhin hori 364,50682nm zen). Gainera, hidrogeno espektroko beste lerro baten uhin luzera ematen du beheko ekuzioak. Formula horren bidez, bere garaian espektrospkopioaren bidez egindako lerroen neurketa batzuk zehaztugabeak zirela erakutsi zuen eta bere formulak gerora aurkitu ziren lerroak iragarri zituen, nahiz eta oraindik ez ikusi. Haren kopurua ere seriearen muga zela frogatu zen. Balmer ekuazioa xurgapen/igorpen lerroen uhin luzera aurkitzeko erabil daiteke eta hasieran honela aurkeztu zen (B Balmer-en konstantea izanik):
Uhin-luzera
B = 3.6450682 x m
m=2
n= zenbaki osoa n>m
Aurrerago, 1888.urtean Johannes Rydberg fisikariak Balmer-en ekuazioa hidrogenoaren trantsizio guztietara orokortu zuen, aurreko atalean (Rydberg-en formula) azaldu dugun ekuazioa ondorioztatuz. Gainera Balmer-en aurkikuntzaren ondoren, beste bost hidrogeno espektro serie aurkitu ziren, diren balioetara igarotzen diren elektroiei dagozkienak.
Paschen seriea (n'=3)
Friedrich Paschen fisikari alemaniarren omenez izendatu zuten. Kasu honetan, Paschen lerro guztiak infragorrien bandan daude. Kontuan izan behar da, serie hau hurrengoarekin (Brackett) gainezartzen da, hau da, Brackett serieko lerro laburrenak Paschen serieen artean kokatzen den uhin luzera bat du. Ondorioz, ondorengo serie guztiak gainezarriegingo dira.
| n | airean (nm) |
| 4 | 1875 |
| 5 | 1282 |
| 6 | 1094 |
| 7 | 1005 |
| 8 | 954.6 |
| ∞ | 820.4 |
Brackett-en seriea (n'=4)
Frederick Sumner Brackett fisikari estatubatuarraren omenez izendatu zen, 1922.urtean lehenengoz espektro lerroak behatu zituelako. Brackett serieko lerro espektroak infragorri urruneko bandetan daude.
| n | airean (nm) |
| 5 | 4051 |
| 6 | 2625 |
| 7 | 2166 |
| 8 | 1944 |
| 9 | 1817 |
| ∞ | 1458 |
Pfund-en seriea (n'=5)
August Herman Pfund-ek 1924.urtean esperimentalki aurkitu zuen.
| n | hutsean (nm) |
| 6 | 7460 |
| 7 | 4654 |
| 8 | 3741 |
| 9 | 3297 |
| 10 | 3039 |
| ∞ | 2279 |
Humphreys-en seriea (n'=6)
1953.urtean Curtis J.Humphreys amerikarrak aurkitu zuen.
| n | hutsean (μm) |
| 7 | 12.37 |
| 8 | 7.503 |
| 9 | 5.908 |
| 10 | 5.129 |
| 11 | 4.673 |
| ∞ | 3.282 |
Hurrengo serieak (n'>6)
Hurrengo seireak ez dira izendatu, baina Rydberg ekuazioaren eredu bera jarraitzen dute. Serie hauek gero eta hedatuago daude eta uhin luzera gero eta handiagoetan gertatzen dira. Lerroak aldiz, gero eta ahulago bihurtzen dira, gertaera atomiko gero eta bitxiagoei dagozkienak.
Hidrogeno atomikoaren zazpigarren seriea, lehen aldiz 1972an, esperimentalki uhin infragorrietan John Strong-ek eta Peter Hansenek Massachusetts Amherst-eko unibertsitatean frogatu zuten.
Aplikazioak

James Franck eta Gustav Ludwig Hertzek 1914an Franck eta Hertz-en esperimentua burutu zuten lehen aldiz. Atomoetan elektroien energia mailen kuantifikazioa frogatzea du helburu. Esperimentuak Bohr-en atomoaren eredu kuantikoa berretsi zuen, atomoek energia kantitate espezifikoak soilik xurgatu zitzaketela frogatuz.
Esperimentuan erabilitako elementuak triodo bat izango da katodo batez, sareta polarizatu batez eta anodo batez osatua. Triodo horrek merkurio gaseosoa duen huts-hodi batean elektroi sorta bat sortuko du.
Orduan, anodoak jasotako korrontearen aldaketa elektroien energia zinetikoaren arabera neurtzen da eta, talken unean, elektroiek izandako energia galerak ondoriozta daiteke.
Erreferentziak
- Lyman, Theodore. (1906-04-01). «The Spectrum of Hydrogen in the Region of Extremely Short Wave-Lengths» The Astrophysical Journal 23: 181. doi:. ISSN 0004-637X. (Noiz kontsultatua: 2021-05-02).
- (Ingelesez) Lyman, Theodore. (1914-05). «An Extension of the Spectrum in the Extreme Ultra-Violet» Nature 93 (2323): 241–241. doi:. ISSN 1476-4687. (Noiz kontsultatua: 2021-05-02).
- (Ingelesez) Balmer, J. J.. (1885). «Notiz über die Spectrallinien des Wasserstoffs» Annalen der Physik 261 (5): 80–87. doi:. ISSN 1521-3889. (Noiz kontsultatua: 2021-05-02).