Fosforilazio oxidatibo
Fosforilazio oxidatiboa arnas kateari lotuta dagoen prozesu metabolikoa da, mitokondrioen gandorretan ATP sortzen duena. Fosforilazio oxidatiboa ez da ATP eratzen duen prozesu bakarra, baina bai nagusia (zelula batean agertzen den ATParen %90a prozesu horren bidez sortzen baita).

Elektroien garraio katean sortzen den energia askeak mitokondrioen barneko mintzean protoien gradiente elektrokimikoa eragiten du; gradiente horrek protoien mugimendua dakar, ATP-sintetasaren entzima aktibatzen duena. ATP sintasa da, hain zuzen ere, ATP molekularen sorrera katalizatzen duena.
NADH eta FADH2 koentzimek askatzen dituzten protoiak ez dira arnas katera pasatzen (elektroiak bai), eta gandor mitokondrialen matrizean aske gelditzen dira. Arnas kateak (gandor mitokondrialen mintzean burutzen dena) energia askea sortzen du 3 puntutan, eta protoiak mugiarazten ditu matrizetik mintzarteko gunera (ikus irudia). Modu horretan protoien kontzentrazioa mintzaren bi aldeetan desberdina da, potentzial elektriko eta kontzentrazioaren gradientea agertuz matrizea eta mintzarteko gunearen artean.
Gradiente horren ondorioz protoiek mintza zeharkatzen dute berriz, matrizera pasatuz. Mintzean topo egiten dute bertan dauden ATP sintasekin, haien konformazioa aldatuz eta beren jarduera entzimatikoa aktibatuz.
ATP sintasa entzima kanal pasibo bat da. Honen bidez, protoiak mintzaren alde batetik bestera igarotzen dira, gradiente elektrokimikoaren energia potentziala, protoi indar eragile deiturikoa, askatuz. Energia hori fosfato talde bat ADP molekula bati lotzeko erabiltzen da, energia potentzial horren zati bat ATP molekularen energia altuko anhidro loturetan biltegiratzen delarik. Hau, mekanismo baten bidez egiten da, non entzimaren zati baten errotazioa gertatzen den protoiak hortik igaro ahala. Ornodunetan, eta seguruenik animalia erreinu osoan, ATP molekula bat sortzen da 2,7 protoi desplazatuko. Organismo batzuk errendimendu txikiagoko ATPasak dituzte.
Badaude ere proteina desakoplatzaile batzuk, protoi-fluxua kontrolatu eta, fosforilazio oxidatiboaren bi faseak desakoplatuz, beroa sortzea ahalbidetzen dutenak.
Esan daiteke, beraz, arnas katea eta fosforilazio oxidatiboa elkarri egokitzen dioten bi prozesuak direla: arnas katea prozesu exergonikoa da, energia askatzen duena, fosforilazio oxidatiboa endergonikoa den bitartean. Mintzean dagoen protoien mugimenduaren bidez elektroien garraio katetik askatutako energia ATP-sintetasa entzimara eramaten da. Protoi-ponpaketa horrek ATP-sintasaren egitura-aldaketa eragiten du, entzima hori gai izanik ATParen sorrera katalizatzeko.
Bizidunek, mantenugai ugari erabiltzen dituzten arren, ia guztiek fosforilazio oxidatiboa egiten dute ATP (metabolismoari energia ematen dion molekula) sortzeko. Bide hori hain da nonahikoa, energia askatzeko modu oso eraginkorra baita hartzidura-prozesu alternatiboekin alderatuta, baita glukolisi anaerobikoarekin ere.
Nahiz eta fosforilazio oxidatiboa metabolismoaren funtsezko zati bat izan, oxigenoaren espezie erreaktiboen proportzio txiki bat sortzen du, hala nola superoxidoa eta hidrogeno peroxidoa, eta, ondorioz, erradikal askeak hedatzen dira. Horrek kalte zelularra eragiten du, gaixotasunak eragiten ditu eta, agian, zahartzea. Hala ere, erradikalek zeregin garrantzitsua dute zelula-seinaleetan, eta, seguru asko, mitokondrioko barne-mintzaren berezko proteinen lotura disulfuroak sortzen. Ibilbide metaboliko hori egiten duten entzimak droga eta produktu toxiko askoren jomuga dira, eta haien jarduera inhibitzen dute.
Kimiosmosia
Fosforilazio oxidatiboak bi erreakzio akoplatuen bidez funtzionatzen du, batak energia askatzen duelarik, exotermikoa, eta bestea honen energiaz baliatzen delarik bere erreakzioa burutzeko. Elektroi garraioaren bidezidorra prozesu exergonikoa da eta hemendik askatzen den energia ATP-aren sintesian erabiltzen da, hau endergonikoa delarik. Elektroi garraio bidezidorretik ATP sintasara doa energia, protoien fluxu bidez, kimiosmosiaren prozesua burutuz.[1] Protoiak mintzaren alde negatibotik, N aldea, alde positibora, P aldea, pasatzen dira. Entzima hauek bateria baten modukoak dira, zirkuituan zehar korrontea eramateko lan egiten dutelarik. Protoien mugimenduak gradiente elektrokimiko bat sortzen du mintzean zehar, protoi indar eragile deiturikoa. Gradiente honek bi osagai ditu: batetik, protoi kontzentrazioaren arteko aldaketa (pH gradiente bat) eta, bestetik, potentzial elektrikoaren aldaketa, karga negatiboa duen N alde batekin. Energiaren zati handiena potentzial elektroikoen diferentzia bezala biltegiratzen da mitokondrietan, baina beste zati bat pH gradiente bezala gordetzen da kloroplastoetan.[2]
ATP sintasak pilatutako energia hau askatzen du, zirkuitua burutuz eta protoi-fluxua ahalbidetuz, malda elektrokimikoaren bidez, berriz ere mintzaren N aldera.[3] Entzima honek motore elektriko baten antzera jokatzen du, protoi indar eragilea erabiltzen baitu bere egituraren errotazioa burutzeko eta mugimendu hori ATP-aren sintesiarekin akoplatzeko.
Fosforilazio oxidatiboan askatutako energia kantitatea handia da, fermentazio anaerobikoan sortutakoarekin alderatuz. Glukolisiak 2 ATP molekula soilik sortzen ditu. Fosforilazio oxidatiboaren bidez, aldiz, 30 eta 36 ATP molekula artean sortzen dira, glukosa molekula bat karbono dioxido eta ur bihurtzean lortzen diren 10 NADH eta 2 sukzinato molekulatatik abiatuz.[4] Emaitza hori, dena den, ATP maximo teorikoa da. Izan ere, praktikan, protoi batzuk mintzean zehar filtratzen dira, ATP-ren produkzioa gutxiagotuz.[5]
Protoi eta elektroi garraiolariak
Elektroi garraio bidezidorrak elektroiak eta protoiak garraiatzen ditu, elektroiak emaileetatik hartzaileetara transferituz eta protoiak mintzean zehar garraiatuz. Prozesu horiek erabiltzen dituzten transferentziazko molekulak disolbagarriak edota proteinei lotutakoak izan daitezke. Mitokondrian, elektroiak mintzen arteko espazioan zehar garraiatzen dira, c zitokromoaren bidez (uretan disolbagarriak diren elektroiak garraiatzen dituen proteina).[6] Horrek elektroiak soilik garraiatzen ditu, proteinaren hemo taldeko burdin atomoaren erredukzioz eta oxidazioz transferituz.
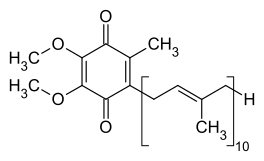
Mitokondriaren barruko mintzean, Q10 koentzimak (CoQ edo UQ), elektroi garraiatzaile liposolublea denak, elektroi zein protoiak garraiatzen ditu erredox ziklo baten bidez.[7] Q koentzima molekula oso hidrofobikoa da, beraz, mintzean zehar barreiatzen da. UQ-k bi elektroi hartzerakoan edo bi protoi askatzerakoan, hidrokinona formara erreduzitzen da (UQH2). Hidrokinonak bi elektroi askatzerakoan edo bi protoi hartzerakoan, bere hasierako formara oxidatzen da, ubikinonara (UQ edo Q). Horren ondorioz, bi entzima antolatuta badaude eta Q mintzaren alde batetik txikitzen bada eta QH2 bestea oxidatzen bada, ubikinona erreakzio horietara akoplatuko da eta protoi-jaurtitzaile gisa jardungo du mintzean zehar.[8] Bakterio-elektroiak garraiatzeko kate batzuek kinona desberdinak erabiltzen dituzte, hala nola menakinona, ukuinoiaz aparte.
Proteinen barruan, elektroiak bi kofaktoreren artean transferitzen dira: flabina-kofaktoreen artean,[3] [9] burdin-sufre zentroak eta zitokromoak. Hainbat motatako burdin-sufre zentroak daude; sinpleenak, elektroien transferentzia-katean dauden bi burdin atomo dira, sufre ez-organiko bi atomorekin lotuak; horiek [2Fe–2S] zentroak dira. Bigarren motak, [4Fe–4S] zentroek, lau burdin atomoko kubo bat eta lau sufre atomo ditu. Zentro horietako burdin atomo bakoitza aminoazido batek koordinatzen du, gehienetan zisteinaren sufre atomoak. Ioi metaliko kofaktoreek erredox erreakzioak zeharkatzen dituzte protoiak lotu edo askatu gabe, eta, beraz, elektroien garraio-katean, proteinen artean elektroiak garraiatzeko baino ez dute balio. Elektroiak distantzia luzeetan mugitzen dira proteinen bidez, kofaktore horiek osatzen dituzten kateen artean saltoka.[10] Hori tunel-efektuagatik gertatzen da, eta azkarra da 1,4–9 m bitarteko distantzietan.[11]
Elektroi garraio bidezidorra
Prozesu kataboliko asko NADH koentzima erreduzituaren bidez eramaten dira aurrera, esaterako, glukolisia, Krebs-en zikloa eta beta oxidazioa. Koentzima honek potentzial handiko elektroiak ditu, hau da, oxidatzerakoan energia asko askatzen du. Hala ere, esan beharra dago, zelulak ez duela energia guzti hau aldi berean askatzen, bestela, erreakzio kontrolaezina izango litzake. Honen ordez, elektroiak NADH-tik kanporatzen dira eta entzima batzuen bidez oxigenora garraiatzen dira, elektroi bakoitzeko energia kantitate txiki bat askatuz. Entzima hauek lau konplexu dira eta elektroi garraio bidezidorra osatzen dute lauren artean. Konplexuak mitokondriaren mintzean kokatzen dira.
Eukariotetan, lehen aipatutako konplexuetatik hiruk, protoiak ponpatzen dituzte mintzaren kanpora, eta horretarako NADHren oxidazioan askatutako energiaz baliatzen dira. Honek, mintzaren kanpoan protoien akumulazio bat eragiten du eta ondorioz, gradiente elektrokimiko bat sortzen da mintzean. Hemen pilatzen den energia, ondoren ATPak sintetizatzeko erabiltzen da, ATP sintasaren bidez.
I.konplexua
NADH-ubikinona oxidoerreduktasa, NADH deshidrogenasa edo I konplexu bezala ere ezagutua, elektroi garraio bidezidorraren lehenengo konplexu proteikoa da. Mintzeko konplexu entzimatiko handienetakoa da, eta elektroi garraio bidezidorreko handiena.
Krebs-en ziklotik datorren NADH-ren bi elektroiak konplexuan dagoen FMN elektroi hartzaileak hartzen ditu, NAD+ sortuz. Jarraian, elektroi horiek Fe-S zentrora pasatzen dira, oxidatuta egotetik erreduzituta egotera pasatzen dena. Behin elektroiak Fe-S zentrotik pasa direla, konplexuan dagoen ubikinona molekula interno batek hartzen ditu bi protoirekin batera (UQH2, hidrokinona).[12] Oro har, konplexu honek katalizatzen duen erreakzioa NADH-ren oxidazioa da, elektroiak kinona batera garraiatuz, ubikinonara (UQ), eta UQH2 sortuz.. Erredox potentzial guztia bi protoiren punpaketa baten bidez itzuliko du (hidrokinonaren bi protoiak askatuz). Askatutako energia gerora erabiltzen da lau protoiren desplazamendurako, matrizetik mintzaren arteko espaziora.
Gertatzen den erreakzio orokorra hurrengoa da:
ΔG⁰ = -81 kJ/mol. ADP-ren fosforilazioa bideratzeko energia nahikoa askatzen da.
Beraz, protoiak punpatzen dira, malda elektrokimikoa bultzatuz eta energia askatuz.
II.konplexua
Sukzinato-Q oxidorreduktasa entzima, II konplexua edo suzinato deshidrogenasa izenez ere ezagutzen dena, elektroien garraio bidezidorreko bigarren sarrera da.[14] Ez da ohikoa, entzima hori baita Krebsen zikloaren prozesuen eta elektroien garraio-katearen parte den bakarra.
II. konplexua lau proteina-azpiunitatek osatzen dute, eta kofaktore gisa flabin adenin dinukleotidoa (FAD), burdin-sufre zentroak eta Q koentzimara elektroiak transferitzen parte hartzen ez duen hemo talde bat ditu, baina uste da garrantzitsua dela oxigenoaren espezie erreaktiboen ekoizpena murrizten dituelako.[15][16]
Sukzinatoa fumaratora oxidatzen du eta ubikinona erreduzitzen du (ubikinonari elektroiak FADH2-k ematen dizkio). Erreakzio horrek NADHren oxidazioak baino energia gutxiago askatzen duenez, II. konplexuak ez du elektroirik garraiatzen mintzean zehar, eta ez dio protoi-gradienteari laguntzen.
Erreakzio orokorra ondorengoa da:
ΔGº= -13,5 kJ/mol (ez da ADP fosforilatzeko nahikoa energia)
III.konplexua
Mamiferoetan konplexu hau dimero bat da eta azpiunitate bakoitzak honako hauek ditu: 11 proteina azpiunitate, Fe-S zentro bat eta hiru zitokromo: zit c1 bat eta bi zit b. Zitokromoak elektroi transferentziako proteinak dira, hemo talde bat dutenak gutxienez. Hemo taldearen barruko burdin atomoek 2 edo 3 oxidazio egoerak dituzte, elektroien transferentzia ematen den bitartean.
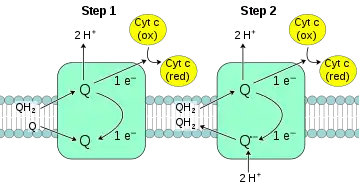
Konplexuaren funtzionamendua: I. eta II.konplexuetatik ubikinona bana ateratzen da 2 elektroirekin, 2 UQH2 (edo QH2) ditugu beraz. Hidrokinona horrek elektroiak Fe-S konplexu bati ematen dizkio eta hortik zit-c1-era pasatzen dira, azkenik, zit c-ra iritsiz. Azken hori elektroiak IV.konpexura eramaten dituen garraiolaria da eta ezaugarri berezi batzuk ditu, horien artean, elektroiak banaka eramaten dituela. Esan bezala, hidrokinonak binaka eramaten ditu elektroiak, beraz, biak hartzeko 2 Cyt c beharko lirateke.
Beraz, momenturen batean sistema bi elektroi maneiatzetik elektroi bakarra maneiatzera pasa behar da. Hidrokinonak elektroi bat ematen dio Cyt c garraiolariari, eta geratzen den semikinonarekin Q zikloa deritzon mekanismoa gertatzen da: 2 UQH٠-ri elektroi bana kentzen zaizkio, eta elektroi gabeko UQ-ri, geroago, 2e- sartuko zaizkio, UQH2 sortuz (bi semikinonatik hidrokinona bat sortu), eta berriro ere prozesua errepikatuz [argazkian ikusten den bezala].
Elektroi transferentzia 2 aldiz ematen da, alde batetik 2 hidrokinonek elektroiak Fe-S zentruari ematean eta, bestetik, 2 semikinonetatik 2 ubikinona sortzean. Beraz, guztira 4H+ punpatuko dira.
Gertatzen den erreakzio orokorra:
UQH2 + 2 zit cox. → UQ + 2 zit cerred.
ΔG⁰’ = -34,2 kJ/mol (ADPren fosforilazioa bideratzeko nahikoa).[12]
IV.konplexua
Konplexu hau, zitokromo oxidasa bezela ere ezaguna da eta elektroi garraio bidezidorreko azken konplexua da.[17] Hirugarren konplexutik laugarrenera elektroiak banaka garraiatzen dira eta behin lau elektroi daudenean lerrokatuta, erreakzioa burutzen da. Hona iristen diren elektroiak oxigenora doaz, beraz, elektroi hartzailea da oxigenoa, eta hau erreduzitu egiten da ura sortuz. Erreakzio hau burutzen den bitartean, protoiak mintzaren kanpora ponpatzen dira.[18] Aipatu bezala, oxigenoa erreduzitu egiten da, baina aldi berean, zitokromo c oxidatu egiten da. Erreakzioan ADParen fosforilazioa burutzeko nahiko energia askatzen da.
Burutzen den erreakzioa honako hau da:
2 zit cerred + 2H+ + ½ O2 → 2 zit cox +H2O
ΔGº= -110 KJ/mol[12]
Konplexuen antolaketa
Jatorrizko ereduaren arabera, aurrez aipatutako konplexuak mitokondriaren mintzean zehar libreki barreiatzen ziren, difusioaren bidez.[19] Berriki lortutako datuek, ordea, konplexuek “superkonplexu” deituriko ordena altuko egiturak osa ditzaketela proposatzen dute.[20] Eredu honek dioenez, hainbat konplexu, elkarrekin interakzionatzen duten entzimaz osatutako mutzo edo agrupazio bezala existitzen dira. Asoziazio horiek substratuen kanalizazioa ahalbidetu dezakete hainbat entzima konplexuren artean, hauen protoi-tranferentzia tasa edo efizientzia handituz.[21] Ugaztunetan agertzen diren superkonplexuen artean, osagai batzuk besteak baino kopuru handiagoan aurkitzen dira, I/II/III/IV konplexuen eta ATP sintasaren arteko tasa 1:1:3:7:4 izanik, hurrenez hurren.[22] Hala ere, superkonplexu hauen hipotesiari buruzko eztabaida ez dago ebatzita oraindik, zenbait datu ez baitira eredu honetara egokitzen.[23][24]
ATP sintasa
ATP sintasa, V konplexua ere esaten zaio, fosforilazio oxidatiboaren prozesuaren azken entzima da. Entzima hori bizi-mota guztietan dago, eta berdin funtzionatzen du prokariotetan nahiz eukariotetan.[25] Entzima horrek protoi-gradiente batean metatutako energia erabiltzen du mintzean zehar, ATParen sintesia ADPtik eta fosfatotik (Pi) egiteko. ATP molekula bat sintetizatzeko behar den protoi-kopuruaren zenbatespenak hiruzpalau dira,[26] [27] eta ikertzaile batzuek aditzera ematen dute zelulek proportzio hori alda dezaketela, hainbat baldintzatara egokitzeko.[28]
Fosforilazio-erreakzio hori oreka bat da, eta aldatu egin daiteke indar motor bat aldatuz. Indar protoi eragilerik ez badago, ATP sintetasaren erreakzioa ezkerrerantz mugituko da, ATP hidrolizatuz eta protoiak matrizetik kanpo mintzaren bidez ponpatuz. Hala ere, indar eragile handia denean, erreakzioa kontrako noranzkoan mugitzera behartzen da; ezkerretik eskuinera, eta protoi-fluxua ahalbidetzen du kontzentrazio-gradientearen noranzkoan, ATPtik ADP sortuz.[25] Are gehiago, lotura estua duen H+-ATPasa proteina bakunkoarekin, erreakzio bera erabiltzen da zelula-konpartimentuak azidotzeko, protoiak ponpatuz eta ATP hidrolizatuz.[29]
ATP sintasa, bi azpiunitatez osatuta dago; bata F0, eta bestea F1. F0 -k sintasaren barruko zatia zeharkatzen du, eta protoiak bertatik igarotzen dira. Aldiz, F1 zatia matrixean kokatzen da. Azken honen mugimenduaren bidez sortzen da ATP-a. F1 zatia α(3), β (3),γ ,δ eta ε proteinaz osatuta dago. Batez, ere erreakzioak eta -n ematen dira erreakzioak.[12]
Protoiak, F0 kanaletik, F1 azpiunitaterako mugimenduaren bidez ATP sortzeko energia iturri dira, baina baita ere honen askatze prozesua ere bultzatzen dute.[12]
F0-tik sartzen diren protoietako bat F1- era pasatzen da eta bestea zuzenean matrixera joatzen da. Prozesu hau burutzeko beharrezkoa da malda bat egotea, eta baita mitokondriaren mintza egoera onean egotea malda mantentzeko. Aipatutako malda hau, elektroi garraioen prozesutik lortuko da, eta honen lanaren arabera, ADP fospatora elkartu eta ATP sortuko da.[12]
ADP eta Pi L (loose) eremura lortzen dira. Proteien fluxuak konformazio aldaketak bultzatzen ditu, odoren ATP sortuz T eremuan (tight), eta sortutako ATPa askatuz eta eremua irekiz (O, open), horrela berriro ADP eta fosfatora elkartzen da, eta zikloa berriz hasten da.[12]
Inhibitzaileak
Droga eta toxina asko existitzen dira, fosforilazio oxidatiboa inhibitzen dutenak. Toxina hauek elektroi garraioko entzima bakarra inhibitzen badute ere, prozesuko zati baten etenaldiak prozesu osoa gelditzen du. Esate baterako, oligomizinak ATP sintasa inhibitzen duenean, protoiek ezin dute mitokondriara itzuli eta ondorioz, gradientea handiegia bihurtzen da.[30] Honela, NADH ez da oxidatzen eta azido zitrikoaren zikloak funtzionatzeari uzten dio, NAD+-aren kontzentrazioa txikiegia gelditzen delako eta beraz entzimek ezin dutelako hontaz baliatu.
- Zianuroa: zianuroa pozoi indartsua da, elektroi garraio bidezidorra eta fosforilazio oxidatiboa inhibitzen dituena, elektroiak zitokromo a3-tik IV.konplexuko oxigenora joatea blokeatzen duena. Elektroi garraio bidezidorra etetearen ondorioz, protoiak ez dira ponpatzen eta ATPrik ez da sortzen. Honen eraginez, NADH eta FADH2 pilatzen joatzen dira. Gainera, zianuroa hemoglobinari lotzen zaio eta oxigenoaren katalisia eteten da horrela.
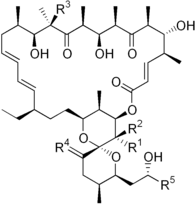
- Oligomizina: Streptomyces bakterioak ekoizten duen antibiotikoa da, ATPren sintesia inhibitzen duena. ATP sintasaren F0 azpiunitatera lotzen da, horzren bidezko protoi garraioa oztopatuz. Elektroi garraioaren katea ere inhibitzen du; beraz, O2ren kontsumoaren jaitsiera eragiten du eta NADH eta FADH2 akumulatzen dira.
- 2,4-dinitrofenola: agente desakoplatzailea da, hau da, fosforilazio oxidatiboko elektroi garraioaren katea desakoplatzen du. 2,4-dinitrofenolak mitokondriaren barruko mintzeko protoiak iragazkor bihurtzen ditu, modu honetan, elektroi garraio katearen (arnas katea) eta fosforilazio oxidatiboaren arteko harremana deseginez. Gainera, efektu fisiologikoetan 2,4-dinitrofenola base bat da eta protoiak hartuz, mintza zeharkatu dezake. Agente honen efektu nagusia, beraz, ATPren ekoizpenaren inhibizioa da, pH gradientea ez baita sortzen; hala ere, elektroi garraioak funtzionatzen jarraitzen du.
Erreferentziak
- Mitchell, P.; Moyle, J.. (1967-01-14). «Chemiosmotic hypothesis of oxidative phosphorylation» Nature 213 (5072): 137–139. doi:. ISSN 0028-0836. PMID 4291593. (Noiz kontsultatua: 2020-05-15).
- Dimroth, P.; Kaim, G.; Matthey, U.. (2000-01). «Crucial role of the membrane potential for ATP synthesis by F(1)F(o) ATP synthases» The Journal of Experimental Biology 203 (Pt 1): 51–59. ISSN 0022-0949. PMID 10600673. (Noiz kontsultatua: 2020-05-15).
- Schultz, B. E.; Chan, S. I.. (2001). «Structures and proton-pumping strategies of mitochondrial respiratory enzymes» Annual Review of Biophysics and Biomolecular Structure 30: 23–65. doi:. ISSN 1056-8700. PMID 11340051. (Noiz kontsultatua: 2020-05-15).
- Rich, P. R.. (2003-12). «The molecular machinery of Keilin's respiratory chain» Biochemical Society Transactions 31 (Pt 6): 1095–1105. doi:. ISSN 0300-5127. PMID 14641005. (Noiz kontsultatua: 2020-05-15).
- Porter, R. K.; Brand, M. D.. (1995-09-01). «Mitochondrial proton conductance and H+/O ratio are independent of electron transport rate in isolated hepatocytes» The Biochemical Journal 310 ( Pt 2): 379–382. doi:. ISSN 0264-6021. PMID 7654171. PMC 1135905. (Noiz kontsultatua: 2020-05-15).
- Mathews, F. S.. «The structure, function and evolution of cytochromes» Prog. Biophys. Mol. Biol. 1: 1-56. 1985 doi:. PMID 3881803..
- Crane, F. L.. (2001). «Biochemical functions of coenzyme Q10» Journal of the American College of Nutrition 6: 591-8. PMID 11771674..
- (Ingelesez) Mitchell, P. (1979-12-07). «Keilin's respiratory chain concept and its chemiosmotic consequences» Science 206 (4423): 1148–1159. doi:. ISSN 0036-8075. (Noiz kontsultatua: 2020-05-15).
- Johnson, Deborah C.; Dean, Dennis R.; Smith, Archer D.; Johnson, Michael K.. (2005). «Structure, function, and formation of biological iron-sulfur clusters» Annual Review of Biochemistry 74: 247–281. doi:. ISSN 0066-4154. PMID 15952888. (Noiz kontsultatua: 2020-05-15).
- Page, C. C.; Moser, C. C.; Chen, X.; Dutton, P. L.. (1999-11-04). «Natural engineering principles of electron tunnelling in biological oxidation-reduction» Nature 402 (6757): 47–52. doi:. ISSN 0028-0836. PMID 10573417. (Noiz kontsultatua: 2020-05-15).
- Leys, David; Scrutton, Nigel S.. (2004-12). «Electrical circuitry in biology: emerging principles from protein structure» Current Opinion in Structural Biology 14 (6): 642–647. doi:. ISSN 0959-440X. PMID 15582386. (Noiz kontsultatua: 2020-05-15).
- Lehninger, Albert L.. (LG 2008). Biokimikaren oinarriak. (2. ed. argitaraldia) Euskal Herriko Unibertsitateko Argitalpen Zerbitzua ISBN 978-84-9860-083-4. PMC 863186105. (Noiz kontsultatua: 2020-05-14).
- Scheffler, Immo E.. (2008). Mitochondria. (2nd ed. argitaraldia) Wiley-Liss ISBN 978-0-470-04073-7. PMC 123692791. (Noiz kontsultatua: 2020-05-15).
- Cecchini, Gary. (2003). «Function and structure of complex II of the respiratory chain» Annual Review of Biochemistry 72: 77–109. doi:. ISSN 0066-4154. PMID 14527321. (Noiz kontsultatua: 2020-05-15).
- Yankovskaya, V.. (2003-01-31). «Architecture of Succinate Dehydrogenase and Reactive Oxygen Species Generation» Science 299 (5607): 700–704. doi:. ISSN 0036-8075. (Noiz kontsultatua: 2020-05-15).
- Horsefield, Rob; Iwata, So; Byrne, Bernadette. (2004-04). «Complex II from a structural perspective» Current Protein & Peptide Science 5 (2): 107–118. doi:. ISSN 1389-2037. PMID 15078221. (Noiz kontsultatua: 2020-05-15).
- (Ingelesez) Calhoun, Melissa W.; Thomas, Jeffrey W.; Gennis, Robert B.. (1994-08). «The cytochrome oxidase superfamily of redox-driven proton pumps» Trends in Biochemical Sciences 19 (8): 325–330. doi:. (Noiz kontsultatua: 2020-05-15).
- (Ingelesez) Yoshikawa, Shinya; Muramoto, Kazumasa; Shinzawa-Itoh, Kyoko; Aoyama, Hiroshi; Tsukihara, Tomitake; Shimokata, Kunitoshi; Katayama, Yukie; Shimada, Hideo. (2006-09). «Proton pumping mechanism of bovine heart cytochrome c oxidase» Biochimica et Biophysica Acta (BBA) - Bioenergetics 1757 (9-10): 1110–1116. doi:. (Noiz kontsultatua: 2020-05-15).
- Lenaz, G.. (2001-12-07). «A critical appraisal of the mitochondrial coenzyme Q pool» FEBS letters 509 (2): 151–155. doi:. ISSN 0014-5793. PMID 11741580. (Noiz kontsultatua: 2020-05-15).
- Heinemeyer, Jesco; Braun, Hans-Peter; Boekema, Egbert J.; Kouril, Roman. (2007-04-20). «A structural model of the cytochrome C reductase/oxidase supercomplex from yeast mitochondria» The Journal of Biological Chemistry 282 (16): 12240–12248. doi:. ISSN 0021-9258. PMID 17322303. (Noiz kontsultatua: 2020-05-15).
- Schägger, Hermann. (2002-09-10). «Respiratory chain supercomplexes of mitochondria and bacteria» Biochimica Et Biophysica Acta 1555 (1-3): 154–159. doi:. ISSN 0006-3002. PMID 12206908. (Noiz kontsultatua: 2020-05-15).
- Schägger, H.; Pfeiffer, K.. (2001-10-12). «The ratio of oxidative phosphorylation complexes I-V in bovine heart mitochondria and the composition of respiratory chain supercomplexes» The Journal of Biological Chemistry 276 (41): 37861–37867. doi:. ISSN 0021-9258. PMID 11483615. (Noiz kontsultatua: 2020-05-15).
- Lenaz, Giorgio; Fato, Romana; Genova, Maria Luisa; Bergamini, Christian; Bianchi, Cristina; Biondi, Annalisa. (2006-09). «Mitochondrial Complex I: structural and functional aspects» Biochimica Et Biophysica Acta 1757 (9-10): 1406–1420. doi:. ISSN 0006-3002. PMID 16828051. (Noiz kontsultatua: 2020-05-15).
- Meistrich, M. L.; Lake, S.; Steinmetz, L. L.; Gledhill, B. L.. (1978-03). «Increased variability in nuclear DNA content of testis cells and spermatozoa from mice with irregular meiotic segregation» Mutation Research 49 (3): 397–405. doi:. ISSN 0027-5107. PMID 345118. (Noiz kontsultatua: 2020-05-15).
- Boyer, P. D.. (1997). «The ATP synthase--a splendid molecular machine» Annual Review of Biochemistry 66: 717–749. doi:. ISSN 0066-4154. PMID 9242922. (Noiz kontsultatua: 2020-05-15).
- Van Walraven, H. S.; Strotmann, H.; Schwarz, O.; Rumberg, B.. (1996-02-05). «The H+/ATP coupling ratio of the ATP synthase from thiol-modulated chloroplasts and two cyanobacterial strains is four» FEBS letters 379 (3): 309–313. doi:. ISSN 0014-5793. PMID 8603713. (Noiz kontsultatua: 2020-05-15).
- Yoshida, M.; Muneyuki, E.; Hisabori, T.. (2001-09). «ATP synthase--a marvellous rotary engine of the cell» Nature Reviews. Molecular Cell Biology 2 (9): 669–677. doi:. ISSN 1471-0072. PMID 11533724. (Noiz kontsultatua: 2020-05-15).
- Schemidt, R. A.; Qu, J.; Williams, J. R.; Brusilow, W. S.. (1998-06). «Effects of carbon source on expression of F0 genes and on the stoichiometry of the c subunit in the F1F0 ATPase of Escherichia coli» Journal of Bacteriology 180 (12): 3205–3208. ISSN 0021-9193. PMID 9620972. PMC PMC107823. (Noiz kontsultatua: 2020-05-15).
- Nelson, N.; Perzov, N.; Cohen, A.; Hagai, K.; Padler, V.; Nelson, H.. (2000-01). «The cellular biology of proton-motive force generation by V-ATPases» The Journal of Experimental Biology 203 (Pt 1): 89–95. ISSN 0022-0949. PMID 10600677. (Noiz kontsultatua: 2020-05-15).
- (Ingelesez) Joshi, Saroj; Huang, Yougou. (1991-08). «ATP synthase complex from bovine heart mitochondria: The oligomycin sensitivity conferring protein is essential for dicyclohexyl carbodiimide-sensitive ATPase» Biochimica et Biophysica Acta (BBA) - Biomembranes 1067 (2): 255–258. doi:. (Noiz kontsultatua: 2020-05-15).